DALTONOV ATOMSKI MODEL Nastao je čitavih 2300 godina posle DEMOKRITA!
|
|
|
- Ἰοῦστος Ιωαννίδης
- 7 χρόνια πριν
- Προβολές:
Transcript
1 DALTONOV ATOMSKI MODEL Nastao je čitavih 2300 godina posle DEMOKRITA! Polazna znanja zakoni o: Održanju mase Stalnom (utvrdjenom) sastavu Umnoženim odnosima Zakon o održanju mase masa supstance ne menja se tokom hemijske reakcije. Može se menjati broj supstanci i njihove osobine, ali ukupna količina materije ne. 180 g glukoze g O2 264 g CO g H2O 372 g pre 372 g posle Opšteprimećeno iskustvo: Na osnovu svih hemičarskih iskustava, može se tvrditi da materija ne može biti stvorena ili uništena.
2 Zakon stalnog sastava bez obzira kako je nastalo, odredjeno hemijsko jedinjenje je sastavljeno uvek od istih elemenata u istom medjusobnom odnosu masa. Primer: CaCO3 20 g CaCO3 1 g CaCO3 % ima: 8 g Ca 0.4 g Ca 40% Ca 2.4 g C 0.12 g C 12% C 9.6 g O 0.48 g O 48% O
3 Zakon umnoženih odnosa Jonh Dalton ako elementi A i B reaguju stvarajući 2 različita jedinjenja onda različite mase supstance B koje reaguju sa istom masom supstance A mogu biti izražene kao odnos malih celih brojeva. Primer: 2 jedinjenja nastala od C i O: CO CO 2 g O/100 g g C/100 g g O/ g C 57.1/42.9 = /27.3 = 2.66 g O/g C u jedinjenju II (CO2) = 2 g O/g C u jedinjenju I (CO) 1 Jedinjenje II sadrži 2 puta više kiseonika na istu masu ugljenika u odnosu na jedinjenje I.
4 DALTONOVA ATOMSKA TEORIJA John Dalton, bez formalnog obrazovanja; matematiku počeo da uči u 12. godini. Bavio se gasovima (zakon), matematikom, meteorologijom i problemom slepila za boje daltonizam. 1. Sva materija sastoji se od atoma, sićušnih nedeljivih čestica jednog elementa koje ne mogu biti stvorene niti uništene ( preuzeto od Demokritovih večnih, neuništivih atoma i u saglasnosti je sa Lavoisier-ovim zakonom održanja mase). Danas znamo da se atomi mogu deliti na subatomske čestice. 2. Atomi jednog elementa ne mogu se pretvoriti u atome drugog elementa. U hemijskoj reakciji, jedinjenje se može podeliti na atome od kojih je nastalo; od istih atoma može nastati drugo jedinjenje. ( ova tvrdnja nastala je nasuprot alhemičarima i magičnoj transformaciji elemenata). Danas znamo da se atom jednog elementa može pretvoriti u atom drugog elementa, ali isključivo u nuklearnim reakcijama, dok se to nikada ne dogadja u hemijskim reakcijama. 3. Atomi jednog elementa imaju identične mase i ostale osobine, i ove osobine se razlikuju od osobina atoma drugih elemenata ( danas znamo da izotopi imaju različite mase). Ovaj postulat je originalno Daltonova ideja. 4. Jedinjenja nastaju kombinovanjem atoma različitih elemenata u specifičnim odnosima. Ovo je Daltonov zaključak, proistekao direktno iz zapažanja o stalnom sastavu.
5 Zakon održanja mase: Daltonovi postulati objasnili su prethodno uočene zakone: Atomi ne mogu biti stvoreni niti uništeni (postulat 1) ili prevedeni u atome drugih elemenata (postulat 2). Kako svaka vrsta atoma ima fiksnu masu (postulat 3) u hemijskoj reakciji se ne može desiti promena mase. Zakon stalnog sastava: Jedinjenje je kombinacija specifičnih odnosa različitih atoma (postulat 4) od kojih svako ima svoju atomsku masu (postulat 3). Zato svaki element u jedinjenju uvek čini stalni udeo od ukupne mase. Zakon umnoženih odnosa: Atomi jednog elementa imaju istu masu (postulat 3) i nedeljivi su (postulat 1). Kada se različiti broj atoma elementa B vezuje sa jednim atomom elementa A nastaju dva različita jedinjenja. Tada, mase elementa B koje reaguju sa istim masama elementa A stoje u celobrojnom odnosu.
6 ATOMSKA TEORIJA DANAS
7 Atom čini nukleus ili jezgro satavljeno od protona i neutrona i elektronski omotač koji je sastavljen od elektrona. Proton je pozitivno naelektrisana čestica koja ima naelektrisanje jednako naelektrisanju elektrona i masu m= x g Jezgro p + n Neutron je neutralna čestica sa masom koja je približno jednaka masi protona m= x10-24 g Elektron je negativno naelektrisana čestica sa masom koja je oko 1836 puta manja od mase protona m= x10-28 g elektronski omotač Atom je neutralan jer je u njemu broj protona u jezgru jednak broju elektrona u atomskom omotaču. Broj neutrona u jezgru je ili jednak ili je veći od broja protona u jezgru.
8 Atomski broj nekog hemijskog elementa predstavlja broj protona u njegovom jezgru i on je jednak broju elektrona u njegovom omotaču. Maseni broj je zbir broja protona i neutrona u atomskom jezgru. Atomska masa svakog elementa je relativni broj koji je izražen u odnsu na 1 amu = x g što predstavlja 1/12 mase 12 C Izotopi nekog elementa imaju u svom sastavu isti broj protona i elektrona a različit broj neutrona. Različiti elementi imaju različit broj izotopa. Izotopi nekog elementa imaju različitu zastupljenost u prirodi.
9
10 Otkriće elektrona Elektron je otkriven proučavanjem katodnih zraka Zraci su emitovani sa katode katodni zraci. Kada se na put ovim katodnim zracima stavi prepreka od fluorescentnog materijala, uočava se da oni putuju pravolinijski ka suprotno naelektrisanoj elektrodi. - katodni zaraci skreću u električnom i magnetnom polju negativno su naelektrisani - katodni zraci nastaju sa katodama od različitih materijala; takodje, sve vrste materijala apsorbuju ovo zračenje, oni su opšti sastavni delovi materije. atomi su deljivi na manje čestice e=1,6 x C m e = kg
11 Otkriće atomskog jezgra Francuska - otkrivena radioaktivnost Rutherford u Engleskoj ispituje interakciju čestica (jezgro helijumovog atoma), sa čvrstim materijalima. čestica je jezgro He atoma sastoji se od 2 protona i 2 neutrona; Naelektrisanje +2.
12 Otkriće atomskog jezgra
13 - Jezgro zauzima 99.97% mase a samo deo njegove zapremine. - Dijametar atoma je oko m, dok je dijametar jezgra oko m. -Broj protona jednak je broju elektrona u atomu, koji je stoga neutralan. -Atom se predstavlja sa: A Z X A - maseni broj (zbir protona i neutrona) Z - redni (atomski) broj elementa X Izotopi su atomi nekog elementa koji imaju isti redni broj (isti broj protona) a različit broj neutrona u jezgru, a time i različit maseni broj.
14 12 C koji ima 6 p+ 6 e - i 6 n 0 13 C koji ima 6 p+ 6 e - i 7 n 0 14 C koji ima 6 p+ 6e - i 8 n 0 Sada, 4 četiri Daltonova postulata mogu da glase: 1. Sva materija sastavljena je od atoma. Mada su atomi sastavljeni od manjih čestica (e -, p+ i n 0 ), atom je najmanje telo koje ima osobine odredjenih elemenata. 2. Atomi nekog elementa mogu se pretvoriti u atome drugog elementa, ali samo u nuklearnim procesima, a nikada u hemijskoj reakciji. 3. Svi atomi nekog elementa imaju isti broj protona i elektrona, što odredjuje ponašanje elementa. Izotopi elementa razlikuju se po broju neutrona, a time i po masenom broju (A), tako da se uzorak nekog elementa tretira kao da atomi imaju srednju masu. 4. Jedinjenja nastaju hemijskom kombinacijom 2 ili više elemenata u specifičnom odnosu (ovaj postulat je originalno Daltonov).
15 NUKLEARNE REAKCIJE, RADIOAKTIVNOST U nuklearnim procesima: Učestvuju jezgra atoma. Može doći do pretvaranja jednog elementa u drugi. Energija koja se oslobađa je milion puta veća od energije hemijske reakcije. Radioaktivna transformacija je ireverzibilna. Radioaktivna transformacija i njena brzina ne zavise od spoljnih fizičkih i hemijskih faktora. Radioaktivnost može biti prirodna i veštačka
16 PRIRODNA RADIOAKTIVNOST Radioaktivni raspad je skup spontanih procesa tokom kojih se nestabilno atomsko jezgro raspada, emitujući pritom subatomske čestice ili visokoenergetsko elektromagnetno zračenje. Tokom radioaktivnog raspada, od jezgra (atoma) jednog elementa može nastati jezgro (atom) drugog elementa. Jezgro koje se raspada naziva se roditelj, dok se nastalo jezgro naziva potomak (ćerka).
17 Radioaktivnost je 1896 otkrio francuski naučnik Henri Becquerel, radeći sa fosforescentnim materijalima. Po njemu, osnovna SI jedinica za radioaktivnost, koja označava količinu radioaktivnog materijala koji daje jedan radioaktivni raspad u jednoj sekundi, dobila je naziv becquerel (Bq). Ovakva radioaktivnost je vrlo mala. Za razliku od bekerela, radioaktivnost od jednog kirija (curie), koja je definisana kao radioaktivnost jednog grama čistog radijuma, iznosi 37 gigabekerela.
18 KOJE ZRAČENJE SE EMITUJE? Najpre je izgledalo da je novootkriveno zračenje slično prethodno otkrivenom X-zračenju. Medjutim, dalja istraživanja Becquerel-a Marie Curie, Pierre Curie, Ernest Rutherford i ostalih pokazalo je da je radioaktivnost mnogo komplikovanija pojava, i da postoji više različitih vrsta zračenja. Električno polje deli to zračenje na 3 različta zraka. alfa, beta, i gama,
19 čestice nose pozitivno naelektrisanje, čestice nose negativno naelektrisanje zraci neutralni. Iz veličine otkolona u električnom polju, zakljušeno je takodje da su čestice masivnije od čestica. Dodatni eksperimenti su pokazali da su čestice jezgra He atoma, a da je radijacija slična katodnim zracima, odnosno da je to zapravo struja elektrona. Takodje uočena je sličnost izmedju radijacije i X - zračenja.
20 RADIOAKTIVNI ELEMENATI SPONTANO EMITUJU Emisija iz jezgra čestice su zapravo elektroni emitovani iz jezgra Gama zraci su elektromagnetni zraci velike energije Alfa čestica se sastoji od dva protona i dva neutrona, što znači da je dvostruko pozitivno naelektrisana čestica, može da jonizuje druge nenaelektrisane čestice
21 Alfa raspad je oblik radioaktivnog raspada kod koga jedno radioaktivno jezgro emituje česticu, a samo se transformiše u jezgro sa masom za 4 broja manjom i atomskim brojem manjim za 2. Alfa čestica je jezgro helijuma; pa se alfa raspad može shvatiti i kao nuklearna fisija, proces u kome se jezgro roditelj deli na dva jezgra potomka.
22 Beta raspad β - raspad neutron se konvertuje u proton pri čemu se emituje elektron i jedan antineutrino: Jedno jezgro se transformiše u drugo, za 1 većeg rednog broja, ali istog masenog broja.
23 Beta raspad β + raspad proton se konvertuje u neutron pri čemu se emituje pozitron i jedan neutrino: p + n 0 + β + + ν e Jedno jezgro se transformiše u drugo, za 1 manjeg rednog broja, ali istog masenog broja Mg Na e
24 Elektronski zahvat je pojava u kojoj jezgro privuče elektron iz omotača, najčesšće iz K ili L sloja. Tada se od tog elektrona i jednog protona iz jezgra formira neutron: p e - n e nastaje jezgro-potomak koje ima broj Z manji za 1, dok je maseni broj A nepromenjen. 55 Fe e - 55 Mn v e
25 Gama raspad Emisija zračenja iz ekscitovanog jezgra prati druge raspade, nuklearne reakcije... Gama zraci ( ) su elektromagnetno zračenje visoke enegrije
26 Može li se predvideti koja su jezgra stabilna a koja ne? Izmedju protona medjusobno postoje odbojne elektrostatičke interakcije i te odbojne interakcije bi prevladale i dovele do destrukcije jezgra da u njemu nema neutrona i privlačnih sila koje vladaju izmedju protona i neutrona, a koje su nazvane jakim silama. Ova sila je oko 100 puta jača od odbojnih sila koje vladaju izmedju protona, ali ona dejstvuje samo na veoma kratkim rastojanjima. Pravilnosti: Postoje samo dva stabilna nuklida koji imaju odnos N/Z < 1: proton i He-3. Od lakših nuklida sa odnosom N/Z 1 stabilni su: C-12, O-16,He-4 i Ne-20. Kako vrednost Z raste, tako i odnos N/Z raste, kod stabilnih nuklida. Nema stabilnih nuklida sa vrednošću N/Z = 1, za Z > 20. Svi nuklidi sa Z > 83 su nestabilni.
27 Nuklidi bogati neutronima (visoka vrednost N/Z) biće podložni β raspadu, u kome se neutron transformiše u proton i tako smanjuje vrednost N/Z. Nuklidi siromašni neutronima (niska vrednost N/Z) biće podložni pozitronskom raspadu ili elektronskom zahvatu, jer će na oba načina proton biti konvertovan u neutron i odnos N/Z povećan. Teški nuklidi sa Z > 83 podležu raspadu, čime se i vrednost Z i vrednost N smanjuju za dve jedinice.
28 Radioaktivni niz Serija raspada do stabilnog jezgra
29 Brzina radioaktivnog raspada (Zakon radioaktivnog raspada) Radioaktivna jezgra raspadaju se karakterističnim brzinama, nezavisno od toga u kojim se supstancama nalaze. Brzina raspada, ili drugačijim imenom, aktivnost (A) radioaktivnog uzorka je promena broja radioaktivnih jezgara (N) u jedinici vremena (t). dn A - dt A N dn - N dt dn - dt dn
30 N t N 0 dn N t 0 dt ln t 1/2 N N 0 t ln2 t Konstanta radioaktivnog raspada i vreme poluživota su karakteristične vrednosti za svaki radioaktivni element.
31 Efekti nuklearnih reakcija na materiju. Detekcija i merenje brzine radioaktivnog raspada. Nuklearne reakcije prouzrokuju hemijske promene u okružujućoj materiji! Ekscitacija. U ovakvim procesima, radijacija relativno slabe energije interaguje sa atomima neke supstance čiji atomi apsorbuju jedan deo energije zračenja i re-emituju je. Jonizacija. U procesima jonizacije, dešava se sudar atoma iz okružujuće materije sa zrakom ili česticom iz radioaktivnog materijala (,β ili γ), koji ima dovoljnu energiju da izbaci elektron iz tog atoma: Atom jonizacija Jon e -
32 Jonizacioni detektor uočava radioaktivno zračenje preko jonizacije koju ono vrši u okruženju. Jonizacija proizvodi slobodne elektrone gasnih katjona, koji onda bivaju privučeni od strane elektrode, tako da nastane struja koja se može meriti. Najpoznatija vrsta ovakvog detektora je Gajger-Milerov brojač. Scintilacioni brojač Upadno zračenje izaziva ekscitaciju ili jonizaciju atoma scintilatora. Ekscitovani atom emituje foton ( nm). Foton dalje pogadja katodu i iz nje izbija elektron putem fotoelektičnog efekta; nastali elektroni formiraju strujni tok koji se može detektovati.
33 Efekti jonizujućeg zračenja na živi svet. čestice su masivne i naelektrisane sa 2 jedinice pozitivnog naelektrisanja, što dovodi do toga da one interaguju sa materijom intenzivnije od ostalih tipova zračenja. Ova interakcija dešava se na veoma kratkom rastojanju, uz jonizaciju okoline čime nastaju značajne promene na okolnim biomolekulima. Zbog ovoga njihov domet u vazduhu nije veliki: potpuno su absorbovane vrlo tankim ( m) mrtvim slojem kože, papirom ili tkaninom, odnosno sa nekoliko cm vazduha. Medjutim, alfa čestice su veoma opasan oblik zračenja ukoliko se nadju UNUTAR živog organizma, jer izazivaju jonizaciju i time veoma opasne promene, čak i genetske transformacije. β čestice i pozitroni imaju manje naelektrisanje i značajno manju masu od čestica, pa zbog toga uočljivo manje interaguju sa materijom, to jest, imaju manji jonizacioni potencijal. Medjutim, β čestice prodiru dublje u materiju pa je potreban sloj metala od oko 0,5 cm (na primer aluminujuma), ili specijalna (teška) odela za zaštitu, da bi bile zaustavljene.
34 zraci, bez mase i naelektrisanja prodiru najviše u materiju. Iz tog razloga, mada gama zračenje vrši jonizaciju u manjoj meri nego i zračenje, ono je naojopasnije jer može da ošteti više slojeva tkiva. Ovo zračenje je u velikoj upotrebi u medicini i u industriji; ali je NEOPHODNO da primene budu pod striktnom kontrolom! - čestice potpuno zaustavlja list papira - čestice zaustavlja Al folija - zračenje može samo biti oslabljeno (debelim slojem olova!
35 Uočeni efekti radijacije moraju se iskazati u nekim kvantitativnim iznosima, pa neophodno je najpre definisati jedinicu primljene energije (primljene doze zračenja). Jonizujuće zračenje dovodi do nastanka parova katjon slobodni elektron mera energije apsorbovane od strane nekog tkiva. U SI sistemu, jedinica za apsorbovanu energiju jonizujućeg zračenja je grej (gray, Gy): koji je jednak energiji od jednog džula koja je apsorbovana od strane jednog kilograma tkiva živog organizma: 1 Gy = 1 J/kg. Druga jedinica, nazvana rad (radiation-absorbed dose), a koja je definisana kao 1 rad = 0.01 J/kg = 0.01 Gy, i u češćoj je upotrebi od greja. RBE faktor (relative biological effectiveness relativna biološka efikasnost). Jedinica za dozu radijacije koja je prouzrokovala odredjeno oštećenje tkiva, nazvana je rem (roentgen equivalent for man): Broj rem-ova = broj rad-a RBE Jedinica prihvaćena u SI sistemu je sivert (Sv) koji je definisan sa: 1 rem = 0,01 Sv.
36 Jonizujuće zračenje interaguje sa molekulom gubitak elektrona iz orbitalne koja čini hemijsku vezu, ili iz nevezujuće orbitale. Slobodni radikali, molekulske ili atomske vrste koje imaju jedan ili više nesparenih elektrona; veoma reaktivne jer imaju lako reaguju sa drugim atomima ili molekulima. H 2 O H OH H 2 O e - H OH e - H RCH = CHR RCH2 CHR Opasnosti od radioaktivnog zračenja nisu odmah uočene!
37 Primene radioizotopa Upotreba malih, kontrolisanih doza. Svi izotopi jednog elementa pokazuju vrlo slično ponašanje u fizičkim i hemijskim procesima. Primena radioaktivnih izotopa kao OBELEŽIVAČA -medicinska dijagnostika ( 131 I, tiroidna žlezda) -praćenje vodenih i vazdušnih tokova -optimalna upotreba veštačkih đubriva ( 45 Ca, 32 P...) -praćenje mehanizma hemijskih reakcija: Reakcija kiseline i alkohola:
38 Drugi primeri primene radionuklida -tretman ćelija malignih tumora ( 60 Co- GAMA NOŽ) -sterilizacija (hrane, hirurških instrumenta...) -sprečavanje razvoja insekata, posebno u predelima gde oni prenose opasne bolesti. -određivanje starosti: 3 H/H 0 40 god 14 C/ 12 C do godina 238 U/ 206 Pb i 235 U/ 207 Pb starost stena (minerala)
39 Nuklearne transmutacije, veštačka radioaktivnost. Pretvaranje jednog jezgra (elementa) u drugi mogu je veštački izazvati Prva veštačka nuklearna transmutacija: bombardovanje atoma azota alfa česticama dobijenim raspadom (1919, Ernst Raderford): 14 4 N H O
40 Kao posledica bombardovanja litijuma, berilijuma ili bora α česticama emituje se novo zračenje koje ima veliku sposobnost prodiranja u materiju, ali koje ne skreće ni u električnom ni u magnetnom polju otkriće neutrona godine, Irena i Frederik Žolio-Kiri stvorili su prvi radioaktivni izotop, u nuklearnoj trasmutaciji u kojoj je aluminijumska folija bombardovana α česticama, i u kojoj je stvoren izotop fosfora do tada nepoznat u prirodi 30 P i jedan neutron: 27 4 Al He n P
41 Fisija i fuzija Fisija je proces u kome se nestabilno jezgro deli na dva lakša (čiji je maseni broj bliži vrednosti 60); uz oslobadjanje viška energije. Postojanje ovog viška energije objašnjava se na sledeći način: atomska jezgra sastoje se od protona i neutrona, ali je njihova masa manja od zbira masa protona i neutrona koji ih grade. Razlika u masama naziva se defekt mase jezgra. Prema teoriji relativnosti, masa je ekvivalentna energiji (E = mc 2 ); pa je ta razlika u masi energija koja drži protone i neutrone vezane u jezgru.
42 Fuzija je proces u kome se lakša jezgra spajaju (kombinuju) tako da nastane teže stabilno jezgro. Kako je i ovde nastalo jezgro stabilnije od početnih, energija se oslobadja kao rezultat ovog procesa. Prirodni procesi fuzije odigravaju se na zvezdama, čija energija upravo potiče od fuzionisanja jezgara vodonika čime nastaje veoma stabilno jezgro helijuma. Ogromna energija fisije mora biti uporebljena na kontrolisani način!!! (ratne i mirnodopske svrhe). Čovek još uvek nije osvojio tehnologiju fuzije.
43 TALASI
44 MEHANIČKI TALASI more Talas se kreće, prelazi velike daljine Čestica se NE KREĆE ZAJEDNO sa talasom Čestica samo OSCILUJE OKO RAVNOTEŽNOG POLOŽAJA Čestica ide gore-dole i levo-desno
45 Transverzalni talasi Pravac oscilacija čestica Pravac prostiranja talasa
46 Transverzalni talasi
47 Transverzalni talasi
48 Longitudinalni talasi Pravac prostiranja talasa Pravac oscilacija čestica
49
50 Ravnotežni položaj T period (trajanje jedne cele osilacije) ν - frekvencija (broj osilacija u sekundi) 1 T
51 Ravnotežni položaj λ talasna dužina Put koji talas pređe tokom jedne oscilacije Brzina kretanja talasa V put vreme T
52 Zvuk
53
54
55 Svetlost elektromagnetni talas c
56 SPEKTAR ELEKTROMAGNETNOG ZRAČENJA
57 Zračenje iz čitavog spektra elektromagnetnog zračenja putuje istom brzinom, ali se razlikuje po frekvenciji, odnosno talasnoj dužini! Zračenje samo jedne talasne dužine naziva se MONOHROMATSKO (grčki - jedna boja ) dok je zračenje sa više talasnih dužina POLIHROMATSKO ( više boja ). Vidljiva svetlost ( = nm) je polihromatska.
58 Početkom XX veka, fizičari su uočili tri fenomena 1) Intenzitet i talasna dužina zračenja koje emituje zagrejano gusto telo ( zračenje crnog tela ); 2) Fotoelektrični efekat - električna struja proizvedena kada zračenje dovoljne energije pada na metal (objašnjenje ovog fenomena je jedan od doprinosa A. Einstein-a) i 3) Atomski spektri - linijski spektri dobijeni od pobudjenih (ekscitiranih) gasova. Elektromegnetno zračenje (EM) i materija Transmisija - EM prolazi kroz meteriju bez ikakve interakcije Apsorpcija - EM biva apsorbovan od strane atoma, jona ili molekula Emisija - oslobadjanje energije od strane atoma, jona ili molekula
59 PROBLEM 1: Zračenje crnog tela Svako zagrejano telo emituje elektromagnetno zračenje. Zračenje je polihromatsko (raznih talasnih dužina) Na različitim Temp Zračenje je različito
60 PROBLEM 1: Zračenje crnog tela Dobro teorijsko objašnjenje nije bilo moguće dok Plank nije postulirao da se Energija emituje i apsorbuje samo u porcijama - KVANTIMA kvant energije ν je frekvencija E = h h je Plankova konstanta h= 6,62 x Js
61 Problem 2: Fotoelektrični efekat Kada svetlost pada na katodu koja je napravljena od jednog od elemenata IA grupe dolazi do emisije elektrona, fotoelektrona.
62 Problem 2: Fotoelektrični efekat Emitovani fotoelektroni se detektuju na anodi. Sve dok upadna svetlost ne dostigne neku odredjenu energiju nema emisije elektrona. Broj emitovanih fotoelektrona ne zavisi od talasne dužine primenjene svetlosti, ali, energija emitovanih elektrona zavisi od talasne dužine upadne svetlosti. Broj elektrona zavisi samo od intenziteta svetlosti - porast intenziteta upadne svetlosti dovodi do porasta broja emitovanih elektrona
63 Problem 2: Fotoelektrični efekat Energija upadne svetlosti je kvantovana i proporcionalna frekvenci E = h = h c/ Ajnštajn: Svetlost se sastoji od čestica,od kojih svaka nosi odredjenu energiju, ta čestica je nazvana foton. Svetlost je dualne prirode i ima osobine i talasa i čestice.
64 Problem 2: Fotoelektrični efekat Sve dok upadna svetlost ne dostigne neku određenu energiju nema emisije elektrona Elektron je vezan u materijalu nekom energijom Da bi elektron bio emitovan, hc Energije kojom je elektron vezan u metalu Energija emitovanih elektrona zavisi od talasne dužine upadne svetlosti.
65 Problem 2: Fotoelektrični efekat Broj fotoelektrona zavisi samo od intenziteta svetlosti - porast intenziteta upadne svetlosti dovodi do porasta broja emitovanih elektrona Intenzitet svetlosti je proporcionalan broju čestica koje poseduju istu energiju. Što više fotona određene energije, to veći broj fotoelektrona.
66 TALASNO ČESTIČNA DUALNOST važi za svu materiju L. de Broglie: Materija je dualne prirode: čestica ima i talasnu prirodu. I obrnuto, talas poseduje osobine čestice. E = mc 2 E= hc/ =h/mc talasna dužina nekog predmeta obrnuto je proporcionalna njegovoj masi; što znači da i veliki predmeti kao što su nebeska tela, prevozna sredstva, kuće, lopte i slično, imaju talasnu dužinu; ali tako malu da je manja od njihovih dimenzija; pa KOD VELIKIH TELA TALASNA PRIRODA NE DOLAZI DO IZRAŽAJA.
67 Supstanca (predmet) Masa (g) Brzina (m/s) (m) Spori elektron Brzi elektron čestica g mase Košarkaška lopta Planeta Zemlja
68 Problem 3: Linijski spektri atoma kada se gasovi pobude termičkom ili električnom energijom, oni potom emituju to, prethodno apsorbovano zračenje, ali u vidu linijskih spektara.
69 Ovo znači da energija koju emituje atom nije kontinualna nego kvantovana. Atom može emitovati samo odredjene količine energije, on može da poseduje samo odredjene energetske vrednosti.
70 Uočene su pravilnosti 1 1 cr 2 2 n k n i k celi brojevi, n < k Ali nije bilo teorije o strukturi atoma koja bi ih objasnila
71 STRUKTURA ATOMSKOG OMOTACA Bohr-ov model atoma
72 Borovi postulati 1. Elektroni se kreću po kružnom orbitama. Elektron u orbiti se nalazi u stacionarnom stanju. 2. Atom ne emituje energiju dok se elektroni nalaze u stacionarniom stanju. Suprotno klasičnom shatanju svako naelektrisanje koje se kreće emituje energiju. Elektron bi gubio energiju i pao na jezgro!!! 3. Atom apsorbuje ili emituje energiju jedino prilikom skoka elektrona sa jedne dopuštene putanje na drugu. Ili: atom može preći iz jedne u drugu stacionarnu putanju samo ako apsorbuje ili emituje foton čija je energija tačno jednaka razlici energija izmedju dva stacionarna stanja: E fotona = E 2 - E 1
73 Vodonikov atom E n Z R 2 1 n 2
74 ...posle mnogo usavršavanja borovog modela... Struktura atomskog omotača danas Elektroni se ne kreću po tačno određenim kružnim ili elipsoidnim putanjama. Tačnu putanju elektrona ne možemo odrediti. Možemo govoriti samo o PROSTORU U KOME JE NAJVEĆA VEROVATNOĆA NALAŽENJA ELEKTRONA ORBITALI Elektroni u atomu su raspoređeni po nivoima, podnivoima i orbitalama. Raspored je određen KVANTNIM BROJEVIMA
75 Glavni kvantni broj (n) određuje pripadnost nivou. Ima dominantni uticaj na energiju elektrona. Vrednosti: n = 0, 1, 2,...
76 Azimutalni kvantni broj (l) određuje pripadnost podnivou. oblik orbitale. Vrednosti zavisi od vrednosti glavnog kvantnog broja: l = 0, 1, 2,... n-1 p orbitala l=1 s orbitala l=0
77 Magnetni kvantni broj (m) određuje broj orbitala u podnivou. orijentaciju orbitale u prostoru. Vrednosti zavisi od vrednosti azimutalnog kvantnog broja: m = -l...l drugi nivo dva podnivoa s i p jedna s orbitala tri p orbitale Primer: n = 2 l = 0 1 m = l = 0, 1, 2,... n-1 m = -l...l
78
79 Spinski kvantni broj (m s ) odredjuje smer rotacije elektrona oko svoje ose. elektroni zapravo nisu loptice koje rotiraju, ali je efekat postojanja spina kao da jesu Vrednost +1/2 ili -1/2.
80 Paulijev princip isključenja U jednom atomu ne mogu postojati dva elektrona sa ista sva četiri kvantna broja Zbog posedovanja spinskog kvantnog broja jedna orbitala ne može imati više od dva elektrona
81 Kvantni brojevi i elektronska konfiguracija n (glavni ) 1, 2, 3,.. Određuje nivo l (angularni) 0, 1, 2,.. n-1 Određuje podnivo (u nivou) m l (magnetni) -l..0..+l Određuje orbitalu (u podnivou) m s (spinski) +1/2, -1/2 Paulijev princip Najviše dva elektrona u jednoj orbitali
82 Podnivoi su sastavljeni od grupe orbitala u elektronskom nivou Broj orbitala n = 1 1 podnivo (s) 1 n = 2 2 podnivoa (s,p) = 4 n = 3 3 podnivoa (s,p,d) = 9 n = 4 4 podnivoa (s,p,d,f) = 16 n = 5 5 podnivoa (s,p,d,f,g)
83 Izgradnja periodnog sistema Svaki naredni element u periodnom sistemu ima po jedan proton u jezgru odnosno po jedan elektron u omotaču više od prethodnog elementa. Taj dodatni elektron se rasporedjuje u raspoloživu orbitalu koja ima najnižu energiju, poštujući pri tome kvantne brojeve i Paulijev princip isključenja. Sve ovo zajedno naziva se pravilom izgradnje Hundovo pravilo
84 Mg (12): 1s 2 2s 2 2p 6 3s 2 Ca (20): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 Prvo 4s pa onda 3d (niža energija) Sc(21): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 f d p s Posle s: najviša moguća
85 Izuzeci postoje primer Cr
86 1 valentni elektron 2+5=7 valentnih elektrona 8 elektrona
87
88 Lewis-ovi simboli elemenata Lewis je predstavio valentne elektrone tačkama. Broj valentnih elektrona se poklapa sa grupom u periodnom sistemu i isti je za elemente u istoj grupi PERIODNOG SISTEMA. H He Li Be B C N O F Ne Groups 1A 2A 3A 4A 5A 6A 7A 8A
89 Elementi teže da dostignu stabilnu elektronsku konfiguraciju najbližeg plemenitog gasa Ne Atomi teže da izgube, da dobiju ili da podele elektrone dok ne dostignu 8 elektrona u ljusci sa najvišim n Pravilo okteta Vodonik je izuzetak jer ima samo jedan elektron. On gradi vezu samo sa jednim elektronskim parom.
90 Jonizacioni potencijal, ili energija jonizacije je energija potrebna da se atomu ili molekulu oduzme 1 elektron. U hemiji, elektron afinitet je količina energije apsorbovana kada je 1 elektron dodat neutralnom izolovanom atomu gasa da bi se dobio jon gasa sa naelektrisanjem -1. On ima negativnu vrednost ako se energija oslobadja jonizacijom. Većina elemenata ima negativni elektron-afinitet. To znači da većini elemenata nije potrebno dovesti energiju da bi dobili elektron, zapravo, oni jonizacijom oslobadjaju energiju. Hlor najjače privlače ekstra elektrone, dok ih radon najslabije privlači.
91
92 Elektronegativnost Elektronegativnost je sposobnost atoma u molekulu da privlači elektron.
93 Glavna pitanja u razumevanju strukture molekula su: - Zašto se jedinjenja stvaraju? - Zašto molekuli imaju svoje karakteristične oblike? - Zašto se neki atomi retko nalaze u jedinjenjima a neki rado prave čitave atomske mreže i lance? Postoje dva osnovna načina na koji se mogu formirati molekuli: Atom može potpuno predati 1 ili više elektrona drugom atomu. Na taj nači nastaju joni koji se drže zajedno zbog elektrostatičkog privlačenja razlnoimenih naboja. Na ovaj način nastaje JONSKA VEZA. Dva atoma mogu deliti (to jest, zajednički posedovati) elektrone. Na ovaj način nastaje KOVALENTNA VEZA. Jonska i kovalentna veza spadaju u kategoriju HEMIJSKIH VEZA.
SAZNANJA O MATERIJI OD STAROG DO XIX VEKA
 SAZNANJA O MATERIJI OD STAROG DO XIX VEKA U najstarija vremena, čovek je svoja poimanja sveta iskazivao mitovima. MIT (mitos) reč, priča, kazivanje (grč.); MITOLOGIJA od, priča i (logos), reč, učenje.
SAZNANJA O MATERIJI OD STAROG DO XIX VEKA U najstarija vremena, čovek je svoja poimanja sveta iskazivao mitovima. MIT (mitos) reč, priča, kazivanje (grč.); MITOLOGIJA od, priča i (logos), reč, učenje.
Osnovni primer. (Z, +,,, 0, 1) je komutativan prsten sa jedinicom: množenje je distributivno prema sabiranju
 RAČUN OSTATAKA 1 1 Prsten celih brojeva Z := N + {} N + = {, 3, 2, 1,, 1, 2, 3,...} Osnovni primer. (Z, +,,,, 1) je komutativan prsten sa jedinicom: sabiranje (S1) asocijativnost x + (y + z) = (x + y)
RAČUN OSTATAKA 1 1 Prsten celih brojeva Z := N + {} N + = {, 3, 2, 1,, 1, 2, 3,...} Osnovni primer. (Z, +,,,, 1) je komutativan prsten sa jedinicom: sabiranje (S1) asocijativnost x + (y + z) = (x + y)
3.1 Granična vrednost funkcije u tački
 3 Granična vrednost i neprekidnost funkcija 2 3 Granična vrednost i neprekidnost funkcija 3. Granična vrednost funkcije u tački Neka je funkcija f(x) definisana u tačkama x za koje je 0 < x x 0 < r, ili
3 Granična vrednost i neprekidnost funkcija 2 3 Granična vrednost i neprekidnost funkcija 3. Granična vrednost funkcije u tački Neka je funkcija f(x) definisana u tačkama x za koje je 0 < x x 0 < r, ili
STRUKTURA ATOMA. Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926)
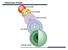 Dalton (803) Tomson (904) Raderford (9) Bor (93) Šredinger (96) OTKRIĆA OSNOVNIH SASTOJAKA ATOMA Do početka XX veka važila je Daltonova atomska teorija o nedeljivosti atoma. Karjem XIX i početkom XX veka
Dalton (803) Tomson (904) Raderford (9) Bor (93) Šredinger (96) OTKRIĆA OSNOVNIH SASTOJAKA ATOMA Do početka XX veka važila je Daltonova atomska teorija o nedeljivosti atoma. Karjem XIX i početkom XX veka
HEMIJSKA VEZA TEORIJA VALENTNE VEZE
 TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
TEORIJA VALENTNE VEZE Kovalentna veza nastaje preklapanjem atomskih orbitala valentnih elektrona, pri čemu je region preklapanja između dva jezgra okupiran parom elektrona. - Nastalu kovalentnu vezu opisuje
Atomska jezgra. Atomska jezgra. Materija. Kristal. Atom. Elektron. Jezgra. Nukleon. Kvark. Stanica
 Atomska jezgra Materija Kristal Atom Elektron Jezgra Nukleon Stanica Kvark Razvoj nuklearne fizike 1896. rođenje nuklearne fizike Becquerel otkrio radioaktivnost 1899. Rutherford pokazao da postoje različite
Atomska jezgra Materija Kristal Atom Elektron Jezgra Nukleon Stanica Kvark Razvoj nuklearne fizike 1896. rođenje nuklearne fizike Becquerel otkrio radioaktivnost 1899. Rutherford pokazao da postoje različite
Osnovne veličine, jedinice i izračunavanja u hemiji
 Osnovne veličine, jedinice i izračunavanja u hemiji Pregled pojmova veličina i njihovih jedinica koje se koriste pri osnovnim izračunavanjima u hemiji dat je u Tabeli 1. Tabela 1. Veličine i njihove jedinice
Osnovne veličine, jedinice i izračunavanja u hemiji Pregled pojmova veličina i njihovih jedinica koje se koriste pri osnovnim izračunavanjima u hemiji dat je u Tabeli 1. Tabela 1. Veličine i njihove jedinice
SEKUNDARNE VEZE međumolekulske veze
 PRIMARNE VEZE hemijske veze među atomima SEKUNDARNE VEZE međumolekulske veze - Slabije od primarnih - Elektrostatičkog karaktera - Imaju veliki uticaj na svojstva supstanci: - agregatno stanje - temperatura
PRIMARNE VEZE hemijske veze među atomima SEKUNDARNE VEZE međumolekulske veze - Slabije od primarnih - Elektrostatičkog karaktera - Imaju veliki uticaj na svojstva supstanci: - agregatno stanje - temperatura
UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET SIGNALI I SISTEMI. Zbirka zadataka
 UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET Goran Stančić SIGNALI I SISTEMI Zbirka zadataka NIŠ, 014. Sadržaj 1 Konvolucija Literatura 11 Indeks pojmova 11 3 4 Sadržaj 1 Konvolucija Zadatak 1. Odrediti konvoluciju
UNIVERZITET U NIŠU ELEKTRONSKI FAKULTET Goran Stančić SIGNALI I SISTEMI Zbirka zadataka NIŠ, 014. Sadržaj 1 Konvolucija Literatura 11 Indeks pojmova 11 3 4 Sadržaj 1 Konvolucija Zadatak 1. Odrediti konvoluciju
SASTAV MATERIJE STRUKTURA ATOMA I PERODNI SISTEM ELEMENATA
 SASTAV MATERIJE STRUKTURA ATOMA I PERODNI SISTEM ELEMENATA Atomi su veoma sitne čestice Još niko nije uspeo da vidi atom Još nije konstruisan takav mikroskop koji će omogućiti da se vidi atom Najbolji
SASTAV MATERIJE STRUKTURA ATOMA I PERODNI SISTEM ELEMENATA Atomi su veoma sitne čestice Još niko nije uspeo da vidi atom Još nije konstruisan takav mikroskop koji će omogućiti da se vidi atom Najbolji
Eliminacijski zadatak iz Matematike 1 za kemičare
 Za mnoge reakcije vrijedi Arrheniusova jednadžba, koja opisuje vezu koeficijenta brzine reakcije i temperature: K = Ae Ea/(RT ). - T termodinamička temperatura (u K), - R = 8, 3145 J K 1 mol 1 opća plinska
Za mnoge reakcije vrijedi Arrheniusova jednadžba, koja opisuje vezu koeficijenta brzine reakcije i temperature: K = Ae Ea/(RT ). - T termodinamička temperatura (u K), - R = 8, 3145 J K 1 mol 1 opća plinska
STRUKTURA ATOMA. Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926)
 Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926) TALASNO MEHANIČKI MODEL ATOMA Hipoteza de Brolja Elektroni i fotoni imaju dvojnu prirodu: talasnu i korpuskularnu. E = hν E = mc
Dalton (1803) Tomson (1904) Raderford (1911) Bor (1913) Šredinger (1926) TALASNO MEHANIČKI MODEL ATOMA Hipoteza de Brolja Elektroni i fotoni imaju dvojnu prirodu: talasnu i korpuskularnu. E = hν E = mc
 Kvantna optika Toplotno zračenje Apsorpciona sposobnost tela je sposobnost apsorbovanja energije zračenja iz intervala l, l+ l na površini tela ds za vreme dt. Apsorpciona moć tela je sposobnost apsorbovanja
Kvantna optika Toplotno zračenje Apsorpciona sposobnost tela je sposobnost apsorbovanja energije zračenja iz intervala l, l+ l na površini tela ds za vreme dt. Apsorpciona moć tela je sposobnost apsorbovanja
Fizika atomskog jezgra Sadržaj
 Osnovne karakteristike atomskog jezgra 30 Defekt mase jezgra i energija veze 303 Stabilnost atomskog jezgra 305 Radioaktivni raspad 308 akon radioaktivnog raspada 309 Vrste radioaktivnog raspada 30 α-radioaktivni
Osnovne karakteristike atomskog jezgra 30 Defekt mase jezgra i energija veze 303 Stabilnost atomskog jezgra 305 Radioaktivni raspad 308 akon radioaktivnog raspada 309 Vrste radioaktivnog raspada 30 α-radioaktivni
Osnovne karakteristike atomskog jezgra
 Osnovne karakteristike atomskog jezgra Otkriće atomskog jezgra (Raderford, 1911., rasejanje α-čestica) - skoro celokupna masa atoma je skoncentrisana u prostoru dimenzija 10 15 m. Jezgro sadrži protone
Osnovne karakteristike atomskog jezgra Otkriće atomskog jezgra (Raderford, 1911., rasejanje α-čestica) - skoro celokupna masa atoma je skoncentrisana u prostoru dimenzija 10 15 m. Jezgro sadrži protone
Elektronska struktura atoma
 Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa u jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa u jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
RADIOHEMIJA.
 RADIOHEMIJA http://www.ffh.bg.ac.rs/geografi_fh_procesi.html 1 ATOM I ATOMSKO JEZGRO Karakteristike elementarnih čestica: elektrona, protona i neutrona Redni i maseni broj hemijskog elementa Izotopi, izobari,
RADIOHEMIJA http://www.ffh.bg.ac.rs/geografi_fh_procesi.html 1 ATOM I ATOMSKO JEZGRO Karakteristike elementarnih čestica: elektrona, protona i neutrona Redni i maseni broj hemijskog elementa Izotopi, izobari,
DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović
 DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović Novi Sad April 17, 2018 1 / 22 Teorija grafova April 17, 2018 2 / 22 Definicija Graf je ure dena trojka G = (V, G, ψ), gde je (i) V konačan skup čvorova,
DISKRETNA MATEMATIKA - PREDAVANJE 7 - Jovanka Pantović Novi Sad April 17, 2018 1 / 22 Teorija grafova April 17, 2018 2 / 22 Definicija Graf je ure dena trojka G = (V, G, ψ), gde je (i) V konačan skup čvorova,
SPEKTROSKOPIJA SPEKTROSKOPIJA
 Spektroskopija je proučavanje interakcija elektromagnetnog zraka (EMZ) sa materijom. Elektromagnetno zračenje Proces koji se odigrava Talasna dužina (m) Energija (J) Frekvencija (Hz) γ-zračenje Nuklearni
Spektroskopija je proučavanje interakcija elektromagnetnog zraka (EMZ) sa materijom. Elektromagnetno zračenje Proces koji se odigrava Talasna dužina (m) Energija (J) Frekvencija (Hz) γ-zračenje Nuklearni
I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI
 dr Ljiljana Vojinović-Ješić I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI ZAKON STALNIH MASENIH ODNOSA (I stehiometrijski zakon, Prust, 1799) Maseni odnos elemenata u datom jedinjenju je stalan, bez obzira na
dr Ljiljana Vojinović-Ješić I HEMIJSKI ZAKONI I STRUKTURA SUPSTANCI ZAKON STALNIH MASENIH ODNOSA (I stehiometrijski zakon, Prust, 1799) Maseni odnos elemenata u datom jedinjenju je stalan, bez obzira na
To je ujedno 1/12 mase atoma ugljika koja je određena eksperimentom i koja iznosi kg. Dakle mase nukleona:
 Nuklearna fizika_intro Osnovne sile u prirodi, građa atomske jezgre, nukleoni i izotopi, energija vezanja jezgre, radioaktivnost, osnovne vrste radioaktivnog zračenja i njihova svojstva, zakon radioaktivnog
Nuklearna fizika_intro Osnovne sile u prirodi, građa atomske jezgre, nukleoni i izotopi, energija vezanja jezgre, radioaktivnost, osnovne vrste radioaktivnog zračenja i njihova svojstva, zakon radioaktivnog
Doc. dr Milena Đukanović
 Doc. dr Milena Đukanović milenadj@ac.me ATOMSKA STRUKTURA MATERIJE: 500 g.p.n.e. Empedokle svijet se sastoji od četiri osnovna elementa: zemlja, vazduh, vatra i voda. 400 g.p.n.e. Demokrit svijet je sagrađen
Doc. dr Milena Đukanović milenadj@ac.me ATOMSKA STRUKTURA MATERIJE: 500 g.p.n.e. Empedokle svijet se sastoji od četiri osnovna elementa: zemlja, vazduh, vatra i voda. 400 g.p.n.e. Demokrit svijet je sagrađen
I.13. Koliki je napon između neke tačke A čiji je potencijal 5 V i referentne tačke u odnosu na koju se taj potencijal računa?
 TET I.1. Šta je Kulonova sila? elektrostatička sila magnetna sila c) gravitaciona sila I.. Šta je elektrostatička sila? sila kojom međusobno eluju naelektrisanja u mirovanju sila kojom eluju naelektrisanja
TET I.1. Šta je Kulonova sila? elektrostatička sila magnetna sila c) gravitaciona sila I.. Šta je elektrostatička sila? sila kojom međusobno eluju naelektrisanja u mirovanju sila kojom eluju naelektrisanja
n (glavni ) 1, 2, 3,.. veličina orbitale i njena energija E= -R(1/n 2 )
 Kvantni brojevi Jedna atomska orbitala je definisana sa tri kvantna broja n l m l Elektroni su rasporedjeni u nivoima i podnivoima n l definiše nivo definiše podnivo ukupni broj orbitala u podnivou: 2
Kvantni brojevi Jedna atomska orbitala je definisana sa tri kvantna broja n l m l Elektroni su rasporedjeni u nivoima i podnivoima n l definiše nivo definiše podnivo ukupni broj orbitala u podnivou: 2
PRAVA. Prava je u prostoru određena jednom svojom tačkom i vektorom paralelnim sa tom pravom ( vektor paralelnosti).
 PRAVA Prava je kao i ravan osnovni geometrijski ojam i ne definiše se. Prava je u rostoru određena jednom svojom tačkom i vektorom aralelnim sa tom ravom ( vektor aralelnosti). M ( x, y, z ) 3 Posmatrajmo
PRAVA Prava je kao i ravan osnovni geometrijski ojam i ne definiše se. Prava je u rostoru određena jednom svojom tačkom i vektorom aralelnim sa tom ravom ( vektor aralelnosti). M ( x, y, z ) 3 Posmatrajmo
Elektronska struktura atoma
 Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
Elektronska struktura atoma Raderfordov atomski model jezgro u sredini pozitivno naelektrisano skoro sva masa jezgru veoma malo Elektroni kruže oko jezgra elektrostatičke interakcije ih drže da ne napuste
Iskazna logika 3. Matematička logika u računarstvu. novembar 2012
 Iskazna logika 3 Matematička logika u računarstvu Department of Mathematics and Informatics, Faculty of Science,, Serbia novembar 2012 Deduktivni sistemi 1 Definicija Deduktivni sistem (ili formalna teorija)
Iskazna logika 3 Matematička logika u računarstvu Department of Mathematics and Informatics, Faculty of Science,, Serbia novembar 2012 Deduktivni sistemi 1 Definicija Deduktivni sistem (ili formalna teorija)
IZVODI ZADACI ( IV deo) Rešenje: Najpre ćemo logaritmovati ovu jednakost sa ln ( to beše prirodni logaritam za osnovu e) a zatim ćemo
 IZVODI ZADACI ( IV deo) LOGARITAMSKI IZVOD Logariamskim izvodom funkcije f(), gde je >0 i, nazivamo izvod logarima e funkcije, o jes: (ln ) f ( ) f ( ) Primer. Nadji izvod funkcije Najpre ćemo logarimovai
IZVODI ZADACI ( IV deo) LOGARITAMSKI IZVOD Logariamskim izvodom funkcije f(), gde je >0 i, nazivamo izvod logarima e funkcije, o jes: (ln ) f ( ) f ( ) Primer. Nadji izvod funkcije Najpre ćemo logarimovai
numeričkih deskriptivnih mera.
 DESKRIPTIVNA STATISTIKA Numeričku seriju podataka opisujemo pomoću Numeričku seriju podataka opisujemo pomoću numeričkih deskriptivnih mera. Pokazatelji centralne tendencije Aritmetička sredina, Medijana,
DESKRIPTIVNA STATISTIKA Numeričku seriju podataka opisujemo pomoću Numeričku seriju podataka opisujemo pomoću numeričkih deskriptivnih mera. Pokazatelji centralne tendencije Aritmetička sredina, Medijana,
3. razred gimnazije- opšti i prirodno-matematički smer ALKENI. Aciklični nezasićeni ugljovodonici koji imaju jednu dvostruku vezu.
 ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
ALKENI Acikliči ezasićei ugljovodoici koji imaju jedu dvostruku vezu. 2 4 2 2 2 (etile) viil grupa 3 6 2 3 2 2 prope (propile) alil grupa 4 8 2 2 3 3 3 2 3 3 1-bute 2-bute 2-metilprope 5 10 2 2 2 2 3 2
Atomi i jezgre 1.1. Atomi i kvanti 1.2. Atomska jezgra λ = h p E = hf, E niži
 tomi i jezgre.. tomi i kvanti.. tomska jezgra Kvant je najmanji mogući iznos neke veličine. Foton, čestica svjetlosti, je kvant energije: gdje je f frekvencija fotona, a h Planckova konstanta. E = hf,
tomi i jezgre.. tomi i kvanti.. tomska jezgra Kvant je najmanji mogući iznos neke veličine. Foton, čestica svjetlosti, je kvant energije: gdje je f frekvencija fotona, a h Planckova konstanta. E = hf,
Teorijske osnove informatike 1
 Teorijske osnove informatike 1 9. oktobar 2014. () Teorijske osnove informatike 1 9. oktobar 2014. 1 / 17 Funkcije Veze me du skupovima uspostavljamo skupovima koje nazivamo funkcijama. Neformalno, funkcija
Teorijske osnove informatike 1 9. oktobar 2014. () Teorijske osnove informatike 1 9. oktobar 2014. 1 / 17 Funkcije Veze me du skupovima uspostavljamo skupovima koje nazivamo funkcijama. Neformalno, funkcija
OBRTNA TELA. Vladimir Marinkov OBRTNA TELA VALJAK
 OBRTNA TELA VALJAK P = 2B + M B = r 2 π M = 2rπH V = BH 1. Zapremina pravog valjka je 240π, a njegova visina 15. Izračunati površinu valjka. Rešenje: P = 152π 2. Površina valjka je 112π, a odnos poluprečnika
OBRTNA TELA VALJAK P = 2B + M B = r 2 π M = 2rπH V = BH 1. Zapremina pravog valjka je 240π, a njegova visina 15. Izračunati površinu valjka. Rešenje: P = 152π 2. Površina valjka je 112π, a odnos poluprečnika
Verovatnoća i Statistika I deo Teorija verovatnoće (zadaci) Beleške dr Bobana Marinkovića
 Verovatnoća i Statistika I deo Teorija verovatnoće zadaci Beleške dr Bobana Marinkovića Iz skupa, 2,, 00} bira se na slučajan način 5 brojeva Odrediti skup elementarnih dogadjaja ako se brojevi biraju
Verovatnoća i Statistika I deo Teorija verovatnoće zadaci Beleške dr Bobana Marinkovića Iz skupa, 2,, 00} bira se na slučajan način 5 brojeva Odrediti skup elementarnih dogadjaja ako se brojevi biraju
Novi Sad god Broj 1 / 06 Veljko Milković Bulevar cara Lazara 56 Novi Sad. Izveštaj o merenju
 Broj 1 / 06 Dana 2.06.2014. godine izmereno je vreme zaustavljanja elektromotora koji je radio u praznom hodu. Iz gradske mreže 230 V, 50 Hz napajan je monofazni asinhroni motor sa dva brusna kamena. Kada
Broj 1 / 06 Dana 2.06.2014. godine izmereno je vreme zaustavljanja elektromotora koji je radio u praznom hodu. Iz gradske mreže 230 V, 50 Hz napajan je monofazni asinhroni motor sa dva brusna kamena. Kada
Elementi spektralne teorije matrica
 Elementi spektralne teorije matrica Neka je X konačno dimenzionalan vektorski prostor nad poljem K i neka je A : X X linearni operator. Definicija. Skalar λ K i nenula vektor u X se nazivaju sopstvena
Elementi spektralne teorije matrica Neka je X konačno dimenzionalan vektorski prostor nad poljem K i neka je A : X X linearni operator. Definicija. Skalar λ K i nenula vektor u X se nazivaju sopstvena
5. Karakteristične funkcije
 5. Karakteristične funkcije Profesor Milan Merkle emerkle@etf.rs milanmerkle.etf.rs Verovatnoća i Statistika-proleće 2018 Milan Merkle Karakteristične funkcije ETF Beograd 1 / 10 Definicija Karakteristična
5. Karakteristične funkcije Profesor Milan Merkle emerkle@etf.rs milanmerkle.etf.rs Verovatnoća i Statistika-proleće 2018 Milan Merkle Karakteristične funkcije ETF Beograd 1 / 10 Definicija Karakteristična
FTN Novi Sad Katedra za motore i vozila. Teorija kretanja drumskih vozila Vučno-dinamičke performanse vozila: MAKSIMALNA BRZINA
 : MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
: MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
ELEKTROTEHNIČKI ODJEL
 MATEMATIKA. Neka je S skup svih živućih državljana Republike Hrvatske..04., a f preslikavanje koje svakom elementu skupa S pridružuje njegov horoskopski znak (bez podznaka). a) Pokažite da je f funkcija,
MATEMATIKA. Neka je S skup svih živućih državljana Republike Hrvatske..04., a f preslikavanje koje svakom elementu skupa S pridružuje njegov horoskopski znak (bez podznaka). a) Pokažite da je f funkcija,
IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI)
 IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI) Izračunavanje pokazatelja načina rada OTVORENOG RM RASPOLOŽIVO RADNO
IZRAČUNAVANJE POKAZATELJA NAČINA RADA NAČINA RADA (ISKORIŠĆENOSTI KAPACITETA, STEPENA OTVORENOSTI RADNIH MESTA I NIVOA ORGANIZOVANOSTI) Izračunavanje pokazatelja načina rada OTVORENOG RM RASPOLOŽIVO RADNO
Skulptura mamuta, dužine samo 3.7cm koja je isklesana od mamutove kljove, delo je umetnika koji je živeo u severozapadnoj Nemačkoj pre godina.
 NUKLEARNA FIZIKA Skulptura mamuta, dužine samo 3.7cm koja je isklesana od mamutove kljove, delo je umetnika koji je živeo u severozapadnoj Nemačkoj pre 35000 godina. Koji fizički principi omogućavaju vremensko
NUKLEARNA FIZIKA Skulptura mamuta, dužine samo 3.7cm koja je isklesana od mamutove kljove, delo je umetnika koji je živeo u severozapadnoj Nemačkoj pre 35000 godina. Koji fizički principi omogućavaju vremensko
SISTEMI NELINEARNIH JEDNAČINA
 SISTEMI NELINEARNIH JEDNAČINA April, 2013 Razni zapisi sistema Skalarni oblik: Vektorski oblik: F = f 1 f n f 1 (x 1,, x n ) = 0 f n (x 1,, x n ) = 0, x = (1) F(x) = 0, (2) x 1 0, 0 = x n 0 Definicije
SISTEMI NELINEARNIH JEDNAČINA April, 2013 Razni zapisi sistema Skalarni oblik: Vektorski oblik: F = f 1 f n f 1 (x 1,, x n ) = 0 f n (x 1,, x n ) = 0, x = (1) F(x) = 0, (2) x 1 0, 0 = x n 0 Definicije
IZVODI ZADACI (I deo)
 IZVODI ZADACI (I deo) Najpre da se podsetimo tablice i osnovnih pravila:. C`=0. `=. ( )`= 4. ( n )`=n n-. (a )`=a lna 6. (e )`=e 7. (log a )`= 8. (ln)`= ` ln a (>0) 9. = ( 0) 0. `= (>0) (ovde je >0 i a
IZVODI ZADACI (I deo) Najpre da se podsetimo tablice i osnovnih pravila:. C`=0. `=. ( )`= 4. ( n )`=n n-. (a )`=a lna 6. (e )`=e 7. (log a )`= 8. (ln)`= ` ln a (>0) 9. = ( 0) 0. `= (>0) (ovde je >0 i a
41. Jednačine koje se svode na kvadratne
 . Jednačine koje se svode na kvadrane Simerične recipročne) jednačine Jednačine oblika a n b n c n... c b a nazivamo simerične jednačine, zbog simeričnosi koeficijenaa koeficijeni uz jednaki). k i n k
. Jednačine koje se svode na kvadrane Simerične recipročne) jednačine Jednačine oblika a n b n c n... c b a nazivamo simerične jednačine, zbog simeričnosi koeficijenaa koeficijeni uz jednaki). k i n k
Ispitivanje toka i skiciranje grafika funkcija
 Ispitivanje toka i skiciranje grafika funkcija Za skiciranje grafika funkcije potrebno je ispitati svako od sledećih svojstava: Oblast definisanosti: D f = { R f R}. Parnost, neparnost, periodičnost. 3
Ispitivanje toka i skiciranje grafika funkcija Za skiciranje grafika funkcije potrebno je ispitati svako od sledećih svojstava: Oblast definisanosti: D f = { R f R}. Parnost, neparnost, periodičnost. 3
PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ).
![PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ). PID: Domen P je glavnoidealski [PID] akko svaki ideal u P je glavni (generisan jednim elementom; oblika ap := {ab b P }, za neko a P ).](/thumbs/74/70316766.jpg) 0.1 Faktorizacija: ID, ED, PID, ND, FD, UFD Definicija. Najava pojmova: [ID], [ED], [PID], [ND], [FD] i [UFD]. ID: Komutativan prsten P, sa jedinicom 1 0, je integralni domen [ID] oblast celih), ili samo
0.1 Faktorizacija: ID, ED, PID, ND, FD, UFD Definicija. Najava pojmova: [ID], [ED], [PID], [ND], [FD] i [UFD]. ID: Komutativan prsten P, sa jedinicom 1 0, je integralni domen [ID] oblast celih), ili samo
XI dvoqas veжbi dr Vladimir Balti. 4. Stabla
 XI dvoqas veжbi dr Vladimir Balti 4. Stabla Teorijski uvod Teorijski uvod Definicija 5.7.1. Stablo je povezan graf bez kontura. Definicija 5.7.1. Stablo je povezan graf bez kontura. Primer 5.7.1. Sva stabla
XI dvoqas veжbi dr Vladimir Balti 4. Stabla Teorijski uvod Teorijski uvod Definicija 5.7.1. Stablo je povezan graf bez kontura. Definicija 5.7.1. Stablo je povezan graf bez kontura. Primer 5.7.1. Sva stabla
S t r a n a 1. 1.Povezati jonsku jačinu rastvora: a) MgCl 2 b) Al 2 (SO 4 ) 3 sa njihovim molalitetima, m. za so tipa: M p X q. pa je jonska jačina:
 S t r a n a 1 1.Povezati jonsku jačinu rastvora: a MgCl b Al (SO 4 3 sa njihovim molalitetima, m za so tipa: M p X q pa je jonska jačina:. Izračunati mase; akno 3 bba(no 3 koje bi trebalo dodati, 0,110
S t r a n a 1 1.Povezati jonsku jačinu rastvora: a MgCl b Al (SO 4 3 sa njihovim molalitetima, m za so tipa: M p X q pa je jonska jačina:. Izračunati mase; akno 3 bba(no 3 koje bi trebalo dodati, 0,110
MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15
 MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15 Matrice - osnovni pojmovi (Matrice i determinante) 2 / 15 (Matrice i determinante) 2 / 15 Matrice - osnovni pojmovi Matrica reda
MATRICE I DETERMINANTE - formule i zadaci - (Matrice i determinante) 1 / 15 Matrice - osnovni pojmovi (Matrice i determinante) 2 / 15 (Matrice i determinante) 2 / 15 Matrice - osnovni pojmovi Matrica reda
UVOD U KVANTNU TEORIJU
 UVOD U KVANTNU TEORIJU UVOD U KVANTNU TEORIJU 1.) FOTOELEKTRIČKI EFEKT 2.) LINIJSKI SPEKTRI ATOMA 3.) BOHROV MODEL ATOMA 4.) CRNO TIJELO 5.) ČESTICE I VALOVI Elektromagnetsko zračenje UVOD U KVANTNU TEORIJU
UVOD U KVANTNU TEORIJU UVOD U KVANTNU TEORIJU 1.) FOTOELEKTRIČKI EFEKT 2.) LINIJSKI SPEKTRI ATOMA 3.) BOHROV MODEL ATOMA 4.) CRNO TIJELO 5.) ČESTICE I VALOVI Elektromagnetsko zračenje UVOD U KVANTNU TEORIJU
Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A
 Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A Ime i prezime: 1. Prikazane su tačke A, B i C i prave a,b i c. Upiši simbole Î, Ï, Ì ili Ë tako da dobijeni iskazi
Kontrolni zadatak (Tačka, prava, ravan, diedar, poliedar, ortogonalna projekcija), grupa A Ime i prezime: 1. Prikazane su tačke A, B i C i prave a,b i c. Upiši simbole Î, Ï, Ì ili Ë tako da dobijeni iskazi
PITANJA IZ NUKLEARNE FIZIKE I RADIOAKTIVNOSTI
 PITANJA IZ NUKLEARNE FIZIKE I RADIOAKTIVNOSTI. Od kojih se čestica sastoji atomska jezgra i koja su osnovna svojstva tih čestica?. Zašto elektroni ne mogu nalaziti u jezgri? 3. Kolika je veličina atoma,
PITANJA IZ NUKLEARNE FIZIKE I RADIOAKTIVNOSTI. Od kojih se čestica sastoji atomska jezgra i koja su osnovna svojstva tih čestica?. Zašto elektroni ne mogu nalaziti u jezgri? 3. Kolika je veličina atoma,
Atomska fizika Sadržaj
 Kvantna svojstva elektromagnetnog zračenja. Ultravioletna katastrofa 79 Plankov zakon zračenja. Bolcmanov i Vinov zakon. 81 Fotoelektrični efekat 83 Komptonovo rasejanje 86 Atomska fizika Sadržaj Atomski
Kvantna svojstva elektromagnetnog zračenja. Ultravioletna katastrofa 79 Plankov zakon zračenja. Bolcmanov i Vinov zakon. 81 Fotoelektrični efekat 83 Komptonovo rasejanje 86 Atomska fizika Sadržaj Atomski
Elektrotehnički fakultet univerziteta u Beogradu 17.maj Odsek za Softversko inžinjerstvo
 Elektrotehnički fakultet univerziteta u Beogradu 7.maj 009. Odsek za Softversko inžinjerstvo Performanse računarskih sistema Drugi kolokvijum Predmetni nastavnik: dr Jelica Protić (35) a) (0) Posmatra
Elektrotehnički fakultet univerziteta u Beogradu 7.maj 009. Odsek za Softversko inžinjerstvo Performanse računarskih sistema Drugi kolokvijum Predmetni nastavnik: dr Jelica Protić (35) a) (0) Posmatra
2 tg x ctg x 1 = =, cos 2x Zbog četvrtog kvadranta rješenje je: 2 ctg x
 Zadatak (Darjan, medicinska škola) Izračunaj vrijednosti trigonometrijskih funkcija broja ako je 6 sin =,,. 6 Rješenje Ponovimo trigonometrijske funkcije dvostrukog kuta! Za argument vrijede sljedeće formule:
Zadatak (Darjan, medicinska škola) Izračunaj vrijednosti trigonometrijskih funkcija broja ako je 6 sin =,,. 6 Rješenje Ponovimo trigonometrijske funkcije dvostrukog kuta! Za argument vrijede sljedeće formule:
Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu
 Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu Trigonometrijske jednačine i nejednačine. Zadaci koji se rade bez upotrebe trigonometrijskih formula. 00. FF cos x sin x
Zadaci sa prethodnih prijemnih ispita iz matematike na Beogradskom univerzitetu Trigonometrijske jednačine i nejednačine. Zadaci koji se rade bez upotrebe trigonometrijskih formula. 00. FF cos x sin x
Betonske konstrukcije 1 - vežbe 3 - Veliki ekscentricitet -Dodatni primeri
 Betonske konstrukcije 1 - vežbe 3 - Veliki ekscentricitet -Dodatni primeri 1 1 Zadatak 1b Čisto savijanje - vezano dimenzionisanje Odrediti potrebnu površinu armature za presek poznatih dimenzija, pravougaonog
Betonske konstrukcije 1 - vežbe 3 - Veliki ekscentricitet -Dodatni primeri 1 1 Zadatak 1b Čisto savijanje - vezano dimenzionisanje Odrediti potrebnu površinu armature za presek poznatih dimenzija, pravougaonog
KVADRATNA FUNKCIJA. Kvadratna funkcija je oblika: Kriva u ravni koja predstavlja grafik funkcije y = ax + bx + c. je parabola.
 KVADRATNA FUNKCIJA Kvadratna funkcija je oblika: = a + b + c Gde je R, a 0 i a, b i c su realni brojevi. Kriva u ravni koja predstavlja grafik funkcije = a + b + c je parabola. Najpre ćemo naučiti kako
KVADRATNA FUNKCIJA Kvadratna funkcija je oblika: = a + b + c Gde je R, a 0 i a, b i c su realni brojevi. Kriva u ravni koja predstavlja grafik funkcije = a + b + c je parabola. Najpre ćemo naučiti kako
SEMINAR IZ KOLEGIJA ANALITIČKA KEMIJA I. Studij Primijenjena kemija
 SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
SEMINAR IZ OLEGIJA ANALITIČA EMIJA I Studij Primijenjena kemija 1. 0,1 mola NaOH je dodano 1 litri čiste vode. Izračunajte ph tako nastale otopine. NaOH 0,1 M NaOH Na OH Jak elektrolit!!! Disoira potpuno!!!
Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama.
 Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama. a b Verovatno a da sluqajna promenljiva X uzima vrednost iz intervala
Apsolutno neprekidne raspodele Raspodele apsolutno neprekidnih sluqajnih promenljivih nazivaju se apsolutno neprekidnim raspodelama. a b Verovatno a da sluqajna promenljiva X uzima vrednost iz intervala
Računarska grafika. Rasterizacija linije
 Računarska grafika Osnovni inkrementalni algoritam Drugi naziv u literaturi digitalni diferencijalni analizator (DDA) Pretpostavke (privremena ograničenja koja se mogu otkloniti jednostavnim uopštavanjem
Računarska grafika Osnovni inkrementalni algoritam Drugi naziv u literaturi digitalni diferencijalni analizator (DDA) Pretpostavke (privremena ograničenja koja se mogu otkloniti jednostavnim uopštavanjem
OM2 V3 Ime i prezime: Index br: I SAVIJANJE SILAMA TANKOZIDNIH ŠTAPOVA
 OM V me i preime: nde br: 1.0.01. 0.0.01. SAVJANJE SLAMA TANKOZDNH ŠTAPOVA A. TANKOZDN ŠTAPOV PROZVOLJNOG OTVORENOG POPREČNOG PRESEKA Preposavka: Smičući napon je konsanan po debljini ida (duž pravca upravnog
OM V me i preime: nde br: 1.0.01. 0.0.01. SAVJANJE SLAMA TANKOZDNH ŠTAPOVA A. TANKOZDN ŠTAPOV PROZVOLJNOG OTVORENOG POPREČNOG PRESEKA Preposavka: Smičući napon je konsanan po debljini ida (duž pravca upravnog
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze:
 Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Mašinsko učenje. Regresija.
 Mašinsko učenje. Regresija. Danijela Petrović May 17, 2016 Uvod Problem predviđanja vrednosti neprekidnog atributa neke instance na osnovu vrednosti njenih drugih atributa. Uvod Problem predviđanja vrednosti
Mašinsko učenje. Regresija. Danijela Petrović May 17, 2016 Uvod Problem predviđanja vrednosti neprekidnog atributa neke instance na osnovu vrednosti njenih drugih atributa. Uvod Problem predviđanja vrednosti
PARCIJALNI IZVODI I DIFERENCIJALI. Sama definicija parcijalnog izvoda i diferencijala je malo teža, mi se njome ovde nećemo baviti a vi ćete je,
 PARCIJALNI IZVODI I DIFERENCIJALI Sama definicija parcijalnog ivoda i diferencijala je malo teža, mi se njome ovde nećemo baviti a vi ćete je, naravno, naučiti onako kako vaš profesor ahteva. Mi ćemo probati
PARCIJALNI IZVODI I DIFERENCIJALI Sama definicija parcijalnog ivoda i diferencijala je malo teža, mi se njome ovde nećemo baviti a vi ćete je, naravno, naučiti onako kako vaš profesor ahteva. Mi ćemo probati
Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže:
 HEMIJSKE VEZE Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže: - prelaskom atoma u pozitivno i negativno naelektrisane jone koji se međusobno privlače, jonska veza - sparivanjem
HEMIJSKE VEZE Pri međusobnom spajanju atoma nastaje energetski stabilniji sistem. To se postiže: - prelaskom atoma u pozitivno i negativno naelektrisane jone koji se međusobno privlače, jonska veza - sparivanjem
M086 LA 1 M106 GRP. Tema: Baza vektorskog prostora. Koordinatni sustav. Norma. CSB nejednakost
 M086 LA 1 M106 GRP Tema: CSB nejednakost. 19. 10. 2017. predavač: Rudolf Scitovski, Darija Marković asistent: Darija Brajković, Katarina Vincetić P 1 www.fizika.unios.hr/grpua/ 1 Baza vektorskog prostora.
M086 LA 1 M106 GRP Tema: CSB nejednakost. 19. 10. 2017. predavač: Rudolf Scitovski, Darija Marković asistent: Darija Brajković, Katarina Vincetić P 1 www.fizika.unios.hr/grpua/ 1 Baza vektorskog prostora.
1. razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MOLEKULA HEMIJSKA VEZA
 EMIJSKE VEZE 1 razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MLEKULA Molekul je najsitnija čestica koja se sastoji od dva ili više istih atoma, a to su molekuli elemenata: Cl 2, 2, N 2,
EMIJSKE VEZE 1 razred gimnazije- opšti i prirodno-matematički smer STRUKTURA MLEKULA Molekul je najsitnija čestica koja se sastoji od dva ili više istih atoma, a to su molekuli elemenata: Cl 2, 2, N 2,
TERMALNOG ZRAČENJA. Plankov zakon Stefan Bolcmanov i Vinov zakon Zračenje realnih tela Razmena snage između dve površine. Ž. Barbarić, MS1-TS 1
 OSNOVNI ZAKONI TERMALNOG ZRAČENJA Plankov zakon Stefan Bolcmanov i Vinov zakon Zračenje realnih tela Razmena snage između dve površine Ž. Barbarić, MS1-TS 1 Plankon zakon zračenja Svako telo čija je temperatura
OSNOVNI ZAKONI TERMALNOG ZRAČENJA Plankov zakon Stefan Bolcmanov i Vinov zakon Zračenje realnih tela Razmena snage između dve površine Ž. Barbarić, MS1-TS 1 Plankon zakon zračenja Svako telo čija je temperatura
Operacije s matricama
 Linearna algebra I Operacije s matricama Korolar 3.1.5. Množenje matrica u vektorskom prostoru M n (F) ima sljedeća svojstva: (1) A(B + C) = AB + AC, A, B, C M n (F); (2) (A + B)C = AC + BC, A, B, C M
Linearna algebra I Operacije s matricama Korolar 3.1.5. Množenje matrica u vektorskom prostoru M n (F) ima sljedeća svojstva: (1) A(B + C) = AB + AC, A, B, C M n (F); (2) (A + B)C = AC + BC, A, B, C M
Izdavač. UNIVERZITET U BEOGRADU Fakultet za fizičku hemiju Beograd, Studentski trg Recenzenti. Urednik... Štampa...
 Izdavač UNIVERZITET U BEOGRADU Fakultet za fizičku hemiju Beograd, Studentski trg 12-16 Recenzenti Urednik... Štampa... Univerzitet u Beogradu-Fakultet za fizičku hemiju 2008. Sva prava zadržana. Nijedan
Izdavač UNIVERZITET U BEOGRADU Fakultet za fizičku hemiju Beograd, Studentski trg 12-16 Recenzenti Urednik... Štampa... Univerzitet u Beogradu-Fakultet za fizičku hemiju 2008. Sva prava zadržana. Nijedan
IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f
 IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f 2. Nule i znak funkcije; presek sa y-osom IspitivaƬe
IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f IspitivaƬe funkcija: 1. Oblast definisanosti funkcije (ili domen funkcije) D f 2. Nule i znak funkcije; presek sa y-osom IspitivaƬe
Konstruisanje. Dobro došli na... SREDNJA MAŠINSKA ŠKOLA NOVI SAD DEPARTMAN ZA PROJEKTOVANJE I KONSTRUISANJE
 Dobro došli na... Konstruisanje GRANIČNI I KRITIČNI NAPON slajd 2 Kritični naponi Izazivaju kritične promene oblika Delovi ne mogu ispravno da vrše funkciju Izazivaju plastične deformacije Može doći i
Dobro došli na... Konstruisanje GRANIČNI I KRITIČNI NAPON slajd 2 Kritični naponi Izazivaju kritične promene oblika Delovi ne mogu ispravno da vrše funkciju Izazivaju plastične deformacije Može doći i
RAD, SNAGA I ENERGIJA
 RAD, SNAGA I ENERGIJA SADRŢAJ 1. MEHANIĈKI RAD SILE 2. SNAGA 3. MEHANIĈKA ENERGIJA a) Kinetiĉka energija b) Potencijalna energija c) Ukupna energija d) Rad kao mera za promenu energije 4. ZAKON ODRŢANJA
RAD, SNAGA I ENERGIJA SADRŢAJ 1. MEHANIĈKI RAD SILE 2. SNAGA 3. MEHANIĈKA ENERGIJA a) Kinetiĉka energija b) Potencijalna energija c) Ukupna energija d) Rad kao mera za promenu energije 4. ZAKON ODRŢANJA
Reverzibilni procesi
 Reverzbln proces Reverzbln proces: proces pr koja sste nkada nje vše od beskonačno ale vrednost udaljen od ravnoteže, beskonačno ala proena spoljašnjh uslova ože vratt sste u blo koju tačku, proena ože
Reverzbln proces Reverzbln proces: proces pr koja sste nkada nje vše od beskonačno ale vrednost udaljen od ravnoteže, beskonačno ala proena spoljašnjh uslova ože vratt sste u blo koju tačku, proena ože
21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE GODINE 8. RAZRED TOČNI ODGOVORI
 21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE 2014. GODINE 8. RAZRED TOČNI ODGOVORI Bodovanje za sve zadatke: - boduju se samo točni odgovori - dodatne upute navedene su za pojedine skupine zadataka
21. ŠKOLSKO/OPĆINSKO/GRADSKO NATJECANJE IZ GEOGRAFIJE 2014. GODINE 8. RAZRED TOČNI ODGOVORI Bodovanje za sve zadatke: - boduju se samo točni odgovori - dodatne upute navedene su za pojedine skupine zadataka
NOMENKLATURA ORGANSKIH SPOJEVA. Imenovanje aromatskih ugljikovodika
 NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
NOMENKLATURA ORGANSKIH SPOJEVA Imenovanje aromatskih ugljikovodika benzen metilbenzen (toluen) 1,2-dimetilbenzen (o-ksilen) 1,3-dimetilbenzen (m-ksilen) 1,4-dimetilbenzen (p-ksilen) fenilna grupa 2-fenilheptan
Atomska fizika Sadržaj
 Atomska fizika Sadržaj Kvantna svojstva elektromagnetnog zračenja. 86 Ultravioletna katastrofa 87 Plankov zakon zračenja. Bolcmanov i Vinov zakon. 88 Fotoelektrični efekat 90 Komptonovo rasejanje 93 Atomski
Atomska fizika Sadržaj Kvantna svojstva elektromagnetnog zračenja. 86 Ultravioletna katastrofa 87 Plankov zakon zračenja. Bolcmanov i Vinov zakon. 88 Fotoelektrični efekat 90 Komptonovo rasejanje 93 Atomski
MEĐUMOLEKULSKE SILE JON-DIPOL DIPOL VODONIČNE NE VEZE DIPOL DIPOL-DIPOL DIPOL-INDUKOVANI INDUKOVANI JON-INDUKOVANI DISPERZNE SILE
 MEĐUMLEKULSKE SILE JN-DIPL VDNIČNE NE VEZE DIPL-DIPL JN-INDUKVANI DIPL DIPL-INDUKVANI INDUKVANI DIPL DISPERZNE SILE MEĐUMLEKULSKE SILE jake JNSKA VEZA (metal-nemetal) KVALENTNA VEZA (nemetal-nemetal) METALNA
MEĐUMLEKULSKE SILE JN-DIPL VDNIČNE NE VEZE DIPL-DIPL JN-INDUKVANI DIPL DIPL-INDUKVANI INDUKVANI DIPL DISPERZNE SILE MEĐUMLEKULSKE SILE jake JNSKA VEZA (metal-nemetal) KVALENTNA VEZA (nemetal-nemetal) METALNA
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze:
 Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Hemijska veza Kada su atomi povezani jedan sa drugim tada kažemo da izmeñu njih postoji hemijska veza Generalno postoji tri vrste hemijske veze: Jonska, Kovalentna i Metalna Luisovi simboli veoma zgodan
Atomska fizika Sadržaj
 Kvantna svojstva elektromagnetnog zračenja. Ultravioletna katastrofa 363 Plankov zakon zračenja. Bolcmanov i Vinov zakon. 365 Fotoelektrični efekat 367 Komptonovo rasejanje 370 Talasna priroda materije.
Kvantna svojstva elektromagnetnog zračenja. Ultravioletna katastrofa 363 Plankov zakon zračenja. Bolcmanov i Vinov zakon. 365 Fotoelektrični efekat 367 Komptonovo rasejanje 370 Talasna priroda materije.
Rad, snaga, energija. Tehnička fizika 1 03/11/2017 Tehnološki fakultet
 Rad, snaga, energija Tehnička fizika 1 03/11/2017 Tehnološki fakultet Rad i energija Da bi rad bio izvršen neophodno je postojanje sile. Sila vrši rad: Pri pomjeranju tijela sa jednog mjesta na drugo Pri
Rad, snaga, energija Tehnička fizika 1 03/11/2017 Tehnološki fakultet Rad i energija Da bi rad bio izvršen neophodno je postojanje sile. Sila vrši rad: Pri pomjeranju tijela sa jednog mjesta na drugo Pri
. Iz lonca ključanjem ispari 100 vode za 5. Toplota
 ELEKTROTEHNIČKI FAKULTET SARAJEVO RIJEŠENI ISPITNI ZADACI IF2 II PARCIJALNI Juni 2009 2A. Sunce zrači kao a.c.t. pri čemu je talasna dužina koja odgovara max. intenziteta zračenja jednaka 480. Naći snagu
ELEKTROTEHNIČKI FAKULTET SARAJEVO RIJEŠENI ISPITNI ZADACI IF2 II PARCIJALNI Juni 2009 2A. Sunce zrači kao a.c.t. pri čemu je talasna dužina koja odgovara max. intenziteta zračenja jednaka 480. Naći snagu
Pošto pretvaramo iz veće u manju mjernu jedinicu broj 2.5 množimo s 1000,
 PRERAČUNAVANJE MJERNIH JEDINICA PRIMJERI, OSNOVNE PRETVORBE, POTENCIJE I ZNANSTVENI ZAPIS, PREFIKSKI, ZADACI S RJEŠENJIMA Primjeri: 1. 2.5 m = mm Pretvaramo iz veće u manju mjernu jedinicu. 1 m ima dm,
PRERAČUNAVANJE MJERNIH JEDINICA PRIMJERI, OSNOVNE PRETVORBE, POTENCIJE I ZNANSTVENI ZAPIS, PREFIKSKI, ZADACI S RJEŠENJIMA Primjeri: 1. 2.5 m = mm Pretvaramo iz veće u manju mjernu jedinicu. 1 m ima dm,
kvantovanim elektronskim orbitama. set matematičkih i konceptualnih alata je stvoren do godine
 Dr Dejan Gvozdić Fizika : Elementi atomske i kvantne fizike 04 Dr Dejan Gvozdić.900. godina Rad Ma Planck-a na problemu zračenja crnog tela uvođenje kvanta energije.. 93. godina Niels Bohr predlog modela
Dr Dejan Gvozdić Fizika : Elementi atomske i kvantne fizike 04 Dr Dejan Gvozdić.900. godina Rad Ma Planck-a na problemu zračenja crnog tela uvođenje kvanta energije.. 93. godina Niels Bohr predlog modela
18. listopada listopada / 13
 18. listopada 2016. 18. listopada 2016. 1 / 13 Neprekidne funkcije Važnu klasu funkcija tvore neprekidne funkcije. To su funkcije f kod kojih mala promjena u nezavisnoj varijabli x uzrokuje malu promjenu
18. listopada 2016. 18. listopada 2016. 1 / 13 Neprekidne funkcije Važnu klasu funkcija tvore neprekidne funkcije. To su funkcije f kod kojih mala promjena u nezavisnoj varijabli x uzrokuje malu promjenu
Zavrxni ispit iz Matematiqke analize 1
 Građevinski fakultet Univerziteta u Beogradu 3.2.2016. Zavrxni ispit iz Matematiqke analize 1 Prezime i ime: Broj indeksa: 1. Definisati Koxijev niz. Dati primer niza koji nije Koxijev. 2. Dat je red n=1
Građevinski fakultet Univerziteta u Beogradu 3.2.2016. Zavrxni ispit iz Matematiqke analize 1 Prezime i ime: Broj indeksa: 1. Definisati Koxijev niz. Dati primer niza koji nije Koxijev. 2. Dat je red n=1
HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO?
 HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO? U OKVIRU OVOG POGLAVLJA ĆEMO RADITI Jonska i kovalentna veza. Metalna veza. Elektronska teorija hemijske veze. Struktura molekula. Međumolekulske interakcije.
HEMIJSKA VEZA ŠTA DRŽI STVARI (ATOME) ZAJEDNO? U OKVIRU OVOG POGLAVLJA ĆEMO RADITI Jonska i kovalentna veza. Metalna veza. Elektronska teorija hemijske veze. Struktura molekula. Međumolekulske interakcije.
RAČUNSKE VEŽBE IZ PREDMETA POLUPROVODNIČKE KOMPONENTE (IV semestar modul EKM) IV deo. Miloš Marjanović
 Univerzitet u Nišu Elektronski fakultet RAČUNSKE VEŽBE IZ PREDMETA (IV semestar modul EKM) IV deo Miloš Marjanović MOSFET TRANZISTORI ZADATAK 35. NMOS tranzistor ima napon praga V T =2V i kroz njega protiče
Univerzitet u Nišu Elektronski fakultet RAČUNSKE VEŽBE IZ PREDMETA (IV semestar modul EKM) IV deo Miloš Marjanović MOSFET TRANZISTORI ZADATAK 35. NMOS tranzistor ima napon praga V T =2V i kroz njega protiče
Gajger Milerov (GM) brojač
 Gajger Milerov (GM) brojač GM brojač (je gasni detektor za detekciju jonizujućeg zračenja (alfa, beta, gama ili X zraka). Njime se ne može odrediti vrsta radioaktivnog zračenja, ali se može izmeriti aktivnost
Gajger Milerov (GM) brojač GM brojač (je gasni detektor za detekciju jonizujućeg zračenja (alfa, beta, gama ili X zraka). Njime se ne može odrediti vrsta radioaktivnog zračenja, ali se može izmeriti aktivnost
Ispitna pitanja iz Osnova hemije
 I grupa pitanja Ispitna pitanja iz Osnova hemije 1. Hijerarhija materijala, smeše, metode razdvajanja smeša Materija: supstance i energija (polje). Supstance se dele na homogene i heterogene supstance.
I grupa pitanja Ispitna pitanja iz Osnova hemije 1. Hijerarhija materijala, smeše, metode razdvajanja smeša Materija: supstance i energija (polje). Supstance se dele na homogene i heterogene supstance.
t H = sec Rg sv
 t H.086 0 7 sec t H :.0867 0 7 sec Rg sv : t H c Ovde sam pokusao da pronadjem tacne cifre magicnih brojeva sa Vajnbergove skale.moja istrazivanja su dovela do zakljucka da su magicni brojevi samo koeficijenti
t H.086 0 7 sec t H :.0867 0 7 sec Rg sv : t H c Ovde sam pokusao da pronadjem tacne cifre magicnih brojeva sa Vajnbergove skale.moja istrazivanja su dovela do zakljucka da su magicni brojevi samo koeficijenti
Kaskadna kompenzacija SAU
 Kaskadna kompenzacija SAU U inženjerskoj praksi, naročito u sistemima regulacije elektromotornih pogona i tehnoloških procesa, veoma često se primenjuje metoda kaskadne kompenzacije, u čijoj osnovi su
Kaskadna kompenzacija SAU U inženjerskoj praksi, naročito u sistemima regulacije elektromotornih pogona i tehnoloških procesa, veoma često se primenjuje metoda kaskadne kompenzacije, u čijoj osnovi su
INTEGRALNI RAČUN. Teorije, metodike i povijest infinitezimalnih računa. Lucija Mijić 17. veljače 2011.
 INTEGRALNI RAČUN Teorije, metodike i povijest infinitezimalnih računa Lucija Mijić lucija@ktf-split.hr 17. veljače 2011. Pogledajmo Predstavimo gornju sumu sa Dodamo još jedan Dobivamo pravokutnik sa Odnosno
INTEGRALNI RAČUN Teorije, metodike i povijest infinitezimalnih računa Lucija Mijić lucija@ktf-split.hr 17. veljače 2011. Pogledajmo Predstavimo gornju sumu sa Dodamo još jedan Dobivamo pravokutnik sa Odnosno
FTN Novi Sad Katedra za motore i vozila. Teorija kretanja drumskih vozila Vučno-dinamičke performanse vozila: MAKSIMALNA BRZINA
 : MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
: MAKSIMALNA BRZINA Maksimalna brzina kretanja F O (N) F OI i m =i I i m =i II F Oid Princip određivanja v MAX : Drugi Njutnov zakon Dokle god je: F O > ΣF otp vozilo ubrzava Kada postane: F O = ΣF otp
TALASNO-MEHANI MEHANIČKI MODEL ATOMA
 TALASNO-MEHANI MEHANIČKI MODEL ATOMA TALASNO-MEHANI MEHANIČKI MODEL ATOMA Kompton (19): svetlost ima i talasnu i korpuskularnu prirodu. Luj De Brolj (193): elektron ima i korpuskularnu i talasnu prirodu.
TALASNO-MEHANI MEHANIČKI MODEL ATOMA TALASNO-MEHANI MEHANIČKI MODEL ATOMA Kompton (19): svetlost ima i talasnu i korpuskularnu prirodu. Luj De Brolj (193): elektron ima i korpuskularnu i talasnu prirodu.
Fizika. Dualna priroda elektromagnetnog zračenja. Princip rada lasera. za studente Geodezije i geomatike. Doc.dr Ivana Stojković
 Fizika za studente Geodezije i geomatike Dualna priroda elektromagnetnog zračenja Princip rada lasera Docdr Ivana Stojković Istorijski razvoj shvatanja prirode svetlosti Korpuskularna teorija svetlosti
Fizika za studente Geodezije i geomatike Dualna priroda elektromagnetnog zračenja Princip rada lasera Docdr Ivana Stojković Istorijski razvoj shvatanja prirode svetlosti Korpuskularna teorija svetlosti
Osnovne teoreme diferencijalnog računa
 Osnovne teoreme diferencijalnog računa Teorema Rolova) Neka je funkcija f definisana na [a, b], pri čemu važi f je neprekidna na [a, b], f je diferencijabilna na a, b) i fa) fb). Tada postoji ξ a, b) tako
Osnovne teoreme diferencijalnog računa Teorema Rolova) Neka je funkcija f definisana na [a, b], pri čemu važi f je neprekidna na [a, b], f je diferencijabilna na a, b) i fa) fb). Tada postoji ξ a, b) tako
7 Algebarske jednadžbe
 7 Algebarske jednadžbe 7.1 Nultočke polinoma Skup svih polinoma nad skupom kompleksnih brojeva označavamo sa C[x]. Definicija. Nultočka polinoma f C[x] je svaki kompleksni broj α takav da je f(α) = 0.
7 Algebarske jednadžbe 7.1 Nultočke polinoma Skup svih polinoma nad skupom kompleksnih brojeva označavamo sa C[x]. Definicija. Nultočka polinoma f C[x] je svaki kompleksni broj α takav da je f(α) = 0.
Periodni sistem elemenata
 Periodni sistem elemenata Periodni sistem elemenata je hemijska tablica u kojoj su po određenoj zakonitosti sistematizovani (poredani) hem.elem. Mendeljejev je je definisao Peridni zakon koji glasi: Hemujske
Periodni sistem elemenata Periodni sistem elemenata je hemijska tablica u kojoj su po određenoj zakonitosti sistematizovani (poredani) hem.elem. Mendeljejev je je definisao Peridni zakon koji glasi: Hemujske
