AS BIOMOLÉCULAS. Carmen Cid Manzano. I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
|
|
|
- ŌΣολομών Ζωγράφου
- 5 χρόνια πριν
- Προβολές:
Transcript
1 AS BIOMOLÉCULAS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía.
2 Os compostos químicos que compartimos todos os seres vivos chámanse BIOMOLÉCULAS OS GLÍCIDOS OU AS PROTEÍNAS Auga CARBOHIDRATOS OS LÍPIDOS OS ÁCIDOS NUCLEICOS Sales minerales
3 BIOMOLÉCULAS OU PRINCIPIOS INMEDIATOS INORGÁNICAS Auga Sales Minerais Biomoléculas non exclusivas da materia viva Probes en enerxía ORGÁNICAS Glícidos Lípidos Proteínas Ácidos nucleicos Biomoléculas exclusivas da materia viva Ricas en enerxía Biolemento imprescindible o C
4
5 ENLACES NAS BIOMOLECULAS ENLACE FORTE ENLACE COVALENTE ENLACES DÉBILES INTERACIÓNS INTRA E INTERMOLECULARES
6 A forza de atracción dos diferentes enlaces que interveñen na estabilización das biomoléculas exprésase en kcal/mol, e corresponde á enerxía liberada ó formar o enlace, ou a enerxía que debe subministrarse para rompelo: Tipo de enlace Forza (kcal/mol) Covalente -50 a 100 Iónico ou salino -1 a 80 Pontes de Hidróxeno -3 a 6 Van der Waals -0,5 a 1 Hidrofóbico -0,5 a 3
7 ENLACE COVALENTE: fórmase cando átomos do mesmo ou de diferente elemento comparten electróns para poder completar a última capa. Trátase dun enlace difícil de romper.
8 As diferentes biomoléculas orgánicas están constituídas basicamente por átomos de carbono unidos entre si mediante enlaces covalentes. Cadea lineal saturada Cadea lineal insaturada Dobre ciclo mixto Cadea ramificada Ciclo mixto
9 Grupos funcionais máis frecuentes nas biomoleculas orgánicas:
10 ENLACES DÉBILES INTERACIÓNS INTRA E INTERMOLECULARES Enlaces que poden darse entre moléculas ou entre partes dunha mesma molécula. Estes enlaces dan unha maior estabilidade ás macromoléculas pola formación de agregados ou de moléculas de maior tamaño. Estas unións poden ser: Ponte disulfuro Enlace iónico ou por forzas electrostáticas Ponte de hidróxeno Enlace por forzas hidrófóbicas Enlace por forzas de Van der Waals
11 Ponte disulfuro: fórmase cando reaccionan dous grupos tiol (-SH) dando -S-S- e H 2. H H S S Pontes disulfuro Forzas iónicas Pontes hidroxeno Estructura terciaria dunha proteína
12 Enlace iónico ou por forzas electrostáticas ou iónicas: establécense entre grupos que teñen carga oposta (+,-). Pontes disulfuro Forzas iónicas Estructura terciaria dunha proteína Pontes hidroxeno
13 Ponte de hidróxeno: establécense entre un elemento electronegativo (O ou N) unido covalentemente a un hidróxeno e outro elemento electronegativo. Este enlace ten moita importancia na polaridade da auga, na estructura das proteínas e do DNA, na solubilidade das moléculas en auga, etc. Pontes disulfuro Forzas iónicas Estructura terciaria dunha proteína Pontes hidroxeno Pontes hidroxeno
14 Pontes de H entre as bases nitroxenadas no DNA Ponte H en auga Pontes de H entre moléculas de auga.
15 Enlace por forzas hidrófóbicas: establécense entre grupos non polares ou que escapan da auga. Forzas hidrofóbicas na estructura da membrana Estructura terciaria dunha proteína Pontes hidroxeno Forzas débiles
16 Enlaces débiles entre la enzima y el sustrato
17 Forzas de Van der Waals As forzas de Van der Waals son o tipo máis débil de forza intermolecular. Son forzas atractivas inespecíficas que ocorren cando a distancia entre dous átomos redúcese a 3-4 Angstrom (Å). Estas forzas débense a asimetrías momentáneas na carga dos átomos a causa do movemento dos electróns. Sen embargo, se os átomos se xuntan máis de 3-4 Å a superposición das capas electrónicas dos átomos orixina a aparición de forzas repulsivas. A forzas de Van der Waals poden ter un papel importante na unión de substratos a encimas e en interaccións entre proteínas e ácidos nucleicos.
18 REPRESENTACIÓNS MOLECULARES DAS BIOMOLECULAS
19 Fórmula desenvolvida: indica todos os átomos e enlaces covalentes da molécula. Fórmula semidesenvolvida: indica unicamente os enlaces da cadea carbonada. Ácido pirúvico Ácido pirúvico Fórmula molecular ou empírica: indica unicamente o número de átomos de cada elemento da molécula. Ácido pirúvico
20 Fórmulas simplificadas: as cadeas carbonadas represéntanse mediante unha liña quebrada na que non se indican carbonos e hidróxenos pero si dobres enlaces u outras variacións que posúe a molécula ( funcións alcohol, ácido, amino, etc.). Ácido palmítico Colesterol
21 REPRESENTACIÓNS ESPACIAIS DAS BIOMOLECULAS
22 Aínda que as fórmulas das biomoléculas represéntanse nun plano os átomos disponse segundo unha complexa representación especial. Modelos de barillas : Representa a trama tridimensional dos enlaces. Fan fincapé nas distancias entre os centros dos átomos e nos ángulos que forman os enlaces. Metano Etano
23 Propano Butano Eteno
24 Hidrocarburo de cadea lineal saturada Dobre enlace Hidrocarburo de cadea lineal insaturada
25 Representacións da molécula de glicosa
26 Modelos compactos ou de bolas: representan a silueta da molécula, mantendo os radios atómicos e os ángulos. Representa o grao de compenetración dos átomos unidos por enlaces covalentes. Representación en modelo de bolas dunha biomolécula
27 As grandes biomoléculas represéntanse esquematicamente. Representación da estructura terciaria dunha proteína Representación do DNA
28 Representación estructura en hélices α nunha proteína Representación estructura en hélices β nunha proteína
29 Concepto de Macromolécula, Monómero e Polímero Macromolécula: biomolécula grande, masa superior a 10 4 da (1da=1uma). Polímero: moléculas resultantes da unión de unidades denominadas monómeros. Polímero Monómero
30 BIOMOLÉCULAS EN AUGA DISPERSIÓNS Disolucións Cando o soluto é de pequeno tamaño (diámetros inferiores a 10-7 cm ). Exemplos: sales minerais, monosacáridos, aminoácidos en auga. Dispersións coloidais As partículas de soluto son grandes (diámetros das partículas superiores oscilan entre 10-7 e cm.) A pesar da elevada masa molecular das moléculas dispersas (coloides), as dispersións coloidais son estables. Exemplos: polisacáridos, proteínas, lípidos, ácidos nucleicos en auga.
31
32 Disolucións iónicas. Auga Auga Ión de Na+ Ión de Cl -
33 disolucións coloidais débese ó feito de que o 90% A importancia das disoluci da materia viva atópase en estado coloidal, sendo o auga o medio en que están dispersas as partículas de tamaño coloidal. Os coloides poden ser de dúas clases: a)micelas: son agrupacións de moitas moléculas pequenas que se aglutinan mediante unións débiles (coloide micelar). b)macromoléculas: moléculas de milimicras ou máis (coloide macromolecular). Hemoglobina
34 Propiedades das dispersións coloidales Capacidade de presentarse en estado de xel o sol: as dispersións coloidales poden presentarse en forma de sol (estado líquido) ou de xel (estado semisólido). Elevada viscosidad: resistencia interna que presenta un líquido ao movemento relativo das súas moléculas. Elevado poder adsorbente: atracción que exerce a superficie dun sólido sobre as moléculas dun líquido ou un gas. Efecto Tyndall: obsérvase certa opalescencia ao iluminar lateralmente as dispersións coloidales sobre un fondo escuro. Sedimentación: se se someten a fortes campos gravitatorios sediméntanse as súas partículas. Diálese: separación de coloides dos cristaloides grazas a unha membrana semipermeable que só permite pasar ás moléculas pequenas. Electroforesis: transporte de partículas coloidales a través dun xel debido á acción dun campo eléctrico.
35 As partículas coloidais mostran unha elevada capacidade de adsorción, favorecendo a atracción entre moléculas que reaccionen nos procesos celulares (exemplo: unión encimasubstrato). As moléculas coloidais, por outro lado, móvense continuamente, impulsadas polo movemento browniano dos coloides na auga (movemento arbitrario e desordenado). Este movemento aumenta a probabilidade de encontro entre as moléculas que reaccionan.
36 Os coloides poden presentar dous estados: O cambio dun estado a outro é reversible. Está condicionado polo ph, Tª e concentración de sales. 1)Estado de sol: É o estado coloidal propiamente dito, onde as partículas do coloide están libres. Presenta aspecto fluído, é dicir, son coloides diluídos (plasma sanguíneo) e ofrecen un aspecto claramente líquido. 2)Estado de xel: É o caso dun coloide que perdeu auga e as partículas floculan, é dicir, agloméranse formando redes que tratan de aprisionar á auga que queda. Presenta un aspecto xelatinoso: son coloides concentrados (masa cerebral, tegumentos).
37 COMPORTAMENTO EN AGUA DAS BIOMOLÉCULAS Solubles (Hidrófilas) - Os ións inorgánicos e orgánicos (ácidos e aminos). - As moléculas polares (alcoles, tioles...) Insolubles (Hidrófobas) - Moléculas apolares (cadeas carbonadas) Anfipáticas - Moléculas cunha parte polar e outra apolar (fosfolípidos)
38 Exemplos de moleculas polares, apolares ou anfipáticas
39 Os ións solubles en auga
40 As graxas son hidrófobas é dicir insolubles en auga
41 Os fosfoglicéridos son anfipáticos, teñen unha parte polar, soluble en auga e unha parte non polar, insoluble. Parte soluble ou polar Parte non soluble ou apolar
42 As biomoléculas anfipáticas forman nun medio acuoso monocapas, bicapas, micelas ou liposomas. Monocapa Bicapa Micela
43
44 MOVEMENTOS NO SENO DA AUGA DIFUSIÓN OSMOSE DIÁLISE
45 A difusión é o fenómeno polo que as moléculas disoltas tenden a distribuírse uniformemente no seno da auga. Pode ocorrer tamén a través dunha membrana si é suficientemente permeable. Deste xeito realízanse os intercambios de gases e dalgúns nutrientes entre a célula e o medio. Difusión
46 Ósmose Se temos dúas disolucións acuosas de distinta concentración separadas por unha membrana semipermeable prodúcese o fenómeno da ósmose que sería un tipo de difusión pasiva caracterizada polo paso da auga (disolvente) a través da membrana semipermeable desde a solución máis diluída (hipotónica) á máis concentrada (hipertónica), este trasego continuará ata que as dúas solucións teñan a mesma concentración (isotónicas ou isoosmóticas). Inicialmente ó mesmo nivel Solución hipotónica Medio cunha baixa concentración Solución hipertónica Medio cunha elevada concentración Membrana semipermeable Permite o paso de disolvente pero non de soluto
47 Enténdese por presión osmótica á presión que sería necesaria para deter o fluxo de auga a través da membrana semipermeable. Ósmose
48 A membrana plasmática da célula pode considerarse como semipermeable, e por elo as células deben permanecer en equilibrio osmótico cos líquidos que as bañan.
49 Comportamento das células animais en solución hipertónica Célula en solución hipertónica A célula perde auga e engurrase H 2 0 H 2 0 H 2 0 PLASMÓLISE LISE
50 Comportamento das células animais en solución hipotónica Célula en solución hipotónica A célula enchese por ingreso de auga no seu interior H 2 0 H 2 0 H 2 0 TURXENCIA
51 Comportamento das células animais en solución hipotónica, isotónica e hipertónica. Entra auga no glóbulo vermello Glóbulo vermello Modificado de Bioloxía COU Anaya Sae auga no glóbulo vermello
52 Comportamento das células vexetais en solución hipotónica, isotónica e hipertónica. Medio hipotónico Turxescencia Medio isotónico Equilibrio Medio hipertónico Plasmolisis
53 Diálise: poden atravesar a membrana ademais do disolvente, moléculas de baixa masa molecular desde a solución máis concentrada á máis diluída. Este é o fundamento da hemodiálise que intenta substituír a filtración renal deteriorada. DIALISE
54 Departamento Bioloxía e Xeoloxía.
Curso A MATERIA VIVA. Tema 1. Bioloxía 2º Bacharelato
 Curso 2014 2015 A MATERA VVA Bioloxía 2º Bacharelato Temario CUGA Clasificación dos compoñentes químicos. Tipos de enlaces químicos presentes na materia viva: covalente, iónico, pontes de hidróxeno, forzas
Curso 2014 2015 A MATERA VVA Bioloxía 2º Bacharelato Temario CUGA Clasificación dos compoñentes químicos. Tipos de enlaces químicos presentes na materia viva: covalente, iónico, pontes de hidróxeno, forzas
2º BAC BIOLOXÍA UNIDADES 1, 2, 3, 4 1
 2º BAC BIOLOXÍA UNIDADES 1, 2, 3, 4 1 Nestas páxinas danse unhas indicacións sobre cada apartado do libro baseadas na información que o Grupo de traballo das PAAU proporciona na páxina web da CIUG (ciug.cesga.es).
2º BAC BIOLOXÍA UNIDADES 1, 2, 3, 4 1 Nestas páxinas danse unhas indicacións sobre cada apartado do libro baseadas na información que o Grupo de traballo das PAAU proporciona na páxina web da CIUG (ciug.cesga.es).
Tema: Enerxía 01/02/06 DEPARTAMENTO DE FÍSICA E QUÍMICA
 Tema: Enerxía 01/0/06 DEPARTAMENTO DE FÍSICA E QUÍMICA Nome: 1. Unha caixa de 150 kg descende dende o repouso por un plano inclinado por acción do seu peso. Se a compoñente tanxencial do peso é de 735
Tema: Enerxía 01/0/06 DEPARTAMENTO DE FÍSICA E QUÍMICA Nome: 1. Unha caixa de 150 kg descende dende o repouso por un plano inclinado por acción do seu peso. Se a compoñente tanxencial do peso é de 735
Procedementos operatorios de unións non soldadas
 Procedementos operatorios de unións non soldadas Técnicas de montaxe de instalacións Ciclo medio de montaxe e mantemento de instalacións frigoríficas 1 de 28 Técnicas de roscado Unha rosca é unha hélice
Procedementos operatorios de unións non soldadas Técnicas de montaxe de instalacións Ciclo medio de montaxe e mantemento de instalacións frigoríficas 1 de 28 Técnicas de roscado Unha rosca é unha hélice
EXERCICIOS AUTOAVALIABLES: RECTAS E PLANOS. 3. Cal é o vector de posición da orixe de coordenadas O? Cales son as coordenadas do punto O?
 EXERCICIOS AUTOAVALIABLES: RECTAS E PLANOS Representa en R os puntos S(2, 2, 2) e T(,, ) 2 Debuxa os puntos M (, 0, 0), M 2 (0,, 0) e M (0, 0, ) e logo traza o vector OM sendo M(,, ) Cal é o vector de
EXERCICIOS AUTOAVALIABLES: RECTAS E PLANOS Representa en R os puntos S(2, 2, 2) e T(,, ) 2 Debuxa os puntos M (, 0, 0), M 2 (0,, 0) e M (0, 0, ) e logo traza o vector OM sendo M(,, ) Cal é o vector de
ENLACE QUÍMICO CUESTIÓNS ENLACE IÓNICO. 1. Considerando o elemento alcalinotérreo do terceiro perquíodo e o segundo elemento do grupo dos halóxenos.
 QQuímica P.A.U. ELACE QUÍMICO 1 ELACE QUÍMICO CUESTIÓS ELACE IÓICO 1. Considerando o elemento alcalinotérreo do terceiro perquíodo e o segundo elemento do grupo dos halóxenos. a) Escribe as súas configuracións
QQuímica P.A.U. ELACE QUÍMICO 1 ELACE QUÍMICO CUESTIÓS ELACE IÓICO 1. Considerando o elemento alcalinotérreo do terceiro perquíodo e o segundo elemento do grupo dos halóxenos. a) Escribe as súas configuracións
Tema 3. Espazos métricos. Topoloxía Xeral,
 Tema 3. Espazos métricos Topoloxía Xeral, 2017-18 Índice Métricas en R n Métricas no espazo de funcións Bólas e relacións métricas Definición Unha métrica nun conxunto M é unha aplicación d con valores
Tema 3. Espazos métricos Topoloxía Xeral, 2017-18 Índice Métricas en R n Métricas no espazo de funcións Bólas e relacións métricas Definición Unha métrica nun conxunto M é unha aplicación d con valores
Profesor: Guillermo F. Cloos Física e química 1º Bacharelato O enlace químico 3 1
 UNIÓNS ENTRE ÁTOMOS, AS MOLÉCULAS E OS CRISTAIS Até agora estudamos os átomos como entidades illadas, pero isto rara vez ocorre na realidade xa que o máis frecuente é que os átomos estea influenciados
UNIÓNS ENTRE ÁTOMOS, AS MOLÉCULAS E OS CRISTAIS Até agora estudamos os átomos como entidades illadas, pero isto rara vez ocorre na realidade xa que o máis frecuente é que os átomos estea influenciados
EXERCICIOS DE REFORZO: RECTAS E PLANOS
 EXERCICIOS DE REFORZO RECTAS E PLANOS Dada a recta r z a) Determna a ecuacón mplícta do plano π que pasa polo punto P(,, ) e é perpendcular a r Calcula o punto de nterseccón de r a π b) Calcula o punto
EXERCICIOS DE REFORZO RECTAS E PLANOS Dada a recta r z a) Determna a ecuacón mplícta do plano π que pasa polo punto P(,, ) e é perpendcular a r Calcula o punto de nterseccón de r a π b) Calcula o punto
TEMA 3. Lípidos. Bioq. Juan Pablo Rodríguez
 TEMA 3 Lípidos Bioq. Juan Pablo Rodríguez Lípidos - Definición Bajo el término Lípidos se agrupan un gran número de compuestos, de estructura química variada, que tienen la propiedad común de ser solubles
TEMA 3 Lípidos Bioq. Juan Pablo Rodríguez Lípidos - Definición Bajo el término Lípidos se agrupan un gran número de compuestos, de estructura química variada, que tienen la propiedad común de ser solubles
Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 PROTEÍNAS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. CONCEPTO As proteínas pódense definir como polímeros formados pola unión, mediante enlaces peptídicos, de unidades
PROTEÍNAS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. CONCEPTO As proteínas pódense definir como polímeros formados pola unión, mediante enlaces peptídicos, de unidades
TEMA 3. ENLACE QUÍMICO
 TEMA 3. ENLACE QUÍMICO ª) ENLACE QUÍMICO Na natureza non existen os átomos de forma aillada, senón que están xuntos formando agregacións chamadas moléculas, ións, A unión entre os átomos é un proceso espontaneo
TEMA 3. ENLACE QUÍMICO ª) ENLACE QUÍMICO Na natureza non existen os átomos de forma aillada, senón que están xuntos formando agregacións chamadas moléculas, ións, A unión entre os átomos é un proceso espontaneo
TEMA 1: LA MATERIA DE LA VIDA
 TEMA 1: LA MATERIA DE LA VIDA La vida y sus niveles de organización. Bioelementos y biomoléculas. Biomoléculas inorgánicas: agua y sales minerales. Biomoléculas orgánicas: glúcidos, lípidos, proteínas
TEMA 1: LA MATERIA DE LA VIDA La vida y sus niveles de organización. Bioelementos y biomoléculas. Biomoléculas inorgánicas: agua y sales minerales. Biomoléculas orgánicas: glúcidos, lípidos, proteínas
Química P.A.U. ENLACE QUÍMICO 1 ENLACE QUÍMICO
 Química P.A.U. ENLAE QUÍMI ENLAE QUÍMI UESTIÓNS ENLAE IÓNI. Razoa cal dos seguintes compostos terá maior punto de fusión: fluoruro de sodio ou bromuro de potasio. (P.A.U. Xuño 96) luoruro de sodio. punto
Química P.A.U. ENLAE QUÍMI ENLAE QUÍMI UESTIÓNS ENLAE IÓNI. Razoa cal dos seguintes compostos terá maior punto de fusión: fluoruro de sodio ou bromuro de potasio. (P.A.U. Xuño 96) luoruro de sodio. punto
Digestión de los lípidos
 Digestión de los lípidos El 90% de los lípidos de la dieta está conformado por triacilglicéridos. El 10% restante está compuesto por fosfolípidos, colesterol, ésteres de colesterol y ácidos grasos libres
Digestión de los lípidos El 90% de los lípidos de la dieta está conformado por triacilglicéridos. El 10% restante está compuesto por fosfolípidos, colesterol, ésteres de colesterol y ácidos grasos libres
ESTRUTURA ATÓMICA E CLASIFICACIÓN PERIÓDICA DOS ELEMENTOS
 Química P.A.U. ESTRUTURA ATÓMICA E CLASIFICACIÓN PERIÓDICA DOS ELEMENTOS ESTRUTURA ATÓMICA E CLASIFICACIÓN PERIÓDICA DOS ELEMENTOS CUESTIÓNS NÚMEROS CUÁNTICOS. a) Indique o significado dos números cuánticos
Química P.A.U. ESTRUTURA ATÓMICA E CLASIFICACIÓN PERIÓDICA DOS ELEMENTOS ESTRUTURA ATÓMICA E CLASIFICACIÓN PERIÓDICA DOS ELEMENTOS CUESTIÓNS NÚMEROS CUÁNTICOS. a) Indique o significado dos números cuánticos
ENLACE QUÍMICO 1. CONCEPTO DE ENLACE EN RELACIÓN COA ESTABILIDADE ENERXÉTICA DOS ÁTOMOS ENLAZADOS.
 ENLACE QUÍMICO 1. Concepto de enlace en relación coa estabilidade enerxética dos átomos enlazados. 2. Enlace iónico. Propiedades das substancias iónicas. Concepto de enerxía de rede. Ciclo de orn-haber.
ENLACE QUÍMICO 1. Concepto de enlace en relación coa estabilidade enerxética dos átomos enlazados. 2. Enlace iónico. Propiedades das substancias iónicas. Concepto de enerxía de rede. Ciclo de orn-haber.
Tema 7. Glúcidos. Grados de oxidación del Carbono. BIOQUÍMICA-1º de Medicina Dpto. Biología Molecular Isabel Andrés. Alqueno.
 Tema 7. Glúcidos. Funciones biológicas. Monosacáridos: nomenclatura y estereoisomería. Pentosas y hexosas. Disacáridos. Enlace glucídico. Polisacáridos de reserva: glucógeno y almidón. Polisacáridos estructurales:
Tema 7. Glúcidos. Funciones biológicas. Monosacáridos: nomenclatura y estereoisomería. Pentosas y hexosas. Disacáridos. Enlace glucídico. Polisacáridos de reserva: glucógeno y almidón. Polisacáridos estructurales:
METABOLISMO DEFINICIÓN :
 1 METABOLISMO DEFINICIÓN : É o conxunto de reaccións químicas que se producen no interior das células e que conducen á transformación dunhas moléculas noutras. As distintas reaccións químicas do metabolismo
1 METABOLISMO DEFINICIÓN : É o conxunto de reaccións químicas que se producen no interior das células e que conducen á transformación dunhas moléculas noutras. As distintas reaccións químicas do metabolismo
PROTEÍNAS. 8. Que é un aminoácido?
 PROTEÍNAS 1. Indique a natureza química, a función e ónde se atopan en maior abundancia as seguintes moléculas: glicóxeno, fosfolípidos, colesterol e queratina 2. En relación ás seguintes macromoléculas:
PROTEÍNAS 1. Indique a natureza química, a función e ónde se atopan en maior abundancia as seguintes moléculas: glicóxeno, fosfolípidos, colesterol e queratina 2. En relación ás seguintes macromoléculas:
2.6 Teoría atómica (unha longa historia)
 2.6 Teoría atómica (unha longa historia) Milleiros de resultados experimentais avalan a idea de que as partículas que forman os gases, os sólidos e os líquidos, en todo o universo, están constituídas por
2.6 Teoría atómica (unha longa historia) Milleiros de resultados experimentais avalan a idea de que as partículas que forman os gases, os sólidos e os líquidos, en todo o universo, están constituídas por
Tema 4.- Biomoléculas orgánicas II: Lípidos.
 Tema 4.- Biomoléculas orgánicas II: Lípidos. A.- Concepto de Lípido. Clasificación. B.- Lípidos complejos o saponificables. -Los ácidos grasos: estructura química, reacciones de esterificación y saponificación.
Tema 4.- Biomoléculas orgánicas II: Lípidos. A.- Concepto de Lípido. Clasificación. B.- Lípidos complejos o saponificables. -Los ácidos grasos: estructura química, reacciones de esterificación y saponificación.
Carmen Cid Manzano. I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 PROTEÍNAS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. CONCEPTO As proteínas pódense definir como polímeros formados pola unión, mediante enlaces peptídicos, de unidades
PROTEÍNAS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. CONCEPTO As proteínas pódense definir como polímeros formados pola unión, mediante enlaces peptídicos, de unidades
Física P.A.U. ELECTROMAGNETISMO 1 ELECTROMAGNETISMO. F = m a
 Física P.A.U. ELECTOMAGNETISMO 1 ELECTOMAGNETISMO INTODUCIÓN MÉTODO 1. En xeral: Debúxanse as forzas que actúan sobre o sistema. Calcúlase a resultante polo principio de superposición. Aplícase a 2ª lei
Física P.A.U. ELECTOMAGNETISMO 1 ELECTOMAGNETISMO INTODUCIÓN MÉTODO 1. En xeral: Debúxanse as forzas que actúan sobre o sistema. Calcúlase a resultante polo principio de superposición. Aplícase a 2ª lei
TEMA 6.- BIOMOLÉCULAS ORGÁNICAS IV: ÁCIDOS NUCLEICOS
 TEMA 6.- BIMLÉCULAS RGÁNICAS IV: ÁCIDS NUCLEICS A.- Características generales de los Ácidos Nucleicos B.- Nucleótidos y derivados nucleotídicos El esqueleto covalente de los ácidos nucleicos: el enlace
TEMA 6.- BIMLÉCULAS RGÁNICAS IV: ÁCIDS NUCLEICS A.- Características generales de los Ácidos Nucleicos B.- Nucleótidos y derivados nucleotídicos El esqueleto covalente de los ácidos nucleicos: el enlace
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA
 Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. O nafaleno (C₁₀H₈) é un composto aromático sólido que se vende para combater a traza. A combustión completa deste composto para producir
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. O nafaleno (C₁₀H₈) é un composto aromático sólido que se vende para combater a traza. A combustión completa deste composto para producir
Ano 2018 FÍSICA. SOL:a...máx. 1,00 Un son grave ten baixa frecuencia, polo que a súa lonxitude de onda é maior.
 ABAU CONVOCAT ORIA DE SET EMBRO Ano 2018 CRIT ERIOS DE AVALI ACIÓN FÍSICA (Cód. 23) Elixir e desenvolver unha das dúas opcións. As solución numéricas non acompañadas de unidades ou con unidades incorrectas...
ABAU CONVOCAT ORIA DE SET EMBRO Ano 2018 CRIT ERIOS DE AVALI ACIÓN FÍSICA (Cód. 23) Elixir e desenvolver unha das dúas opcións. As solución numéricas non acompañadas de unidades ou con unidades incorrectas...
XEOMETRÍA NO ESPAZO. - Se dun vector se coñecen a orixe, o módulo, a dirección e o sentido, este está perfectamente determinado no espazo.
 XEOMETRÍA NO ESPAZO Vectores fixos Dos puntos do espazo, A e B, determinan o vector fixo AB, sendo o punto A a orixe e o punto B o extremo, é dicir, un vector no espazo é calquera segmento orientado que
XEOMETRÍA NO ESPAZO Vectores fixos Dos puntos do espazo, A e B, determinan o vector fixo AB, sendo o punto A a orixe e o punto B o extremo, é dicir, un vector no espazo é calquera segmento orientado que
CATABOLISMO. Carmen Cid Manzano. I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 CATABOLISMO Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. Nos procesos catabólicos as moléculas orgánicas degrádanse, paso a paso, ata formar outras moléculas máis
CATABOLISMO Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. Nos procesos catabólicos as moléculas orgánicas degrádanse, paso a paso, ata formar outras moléculas máis
A proba constará de vinte cuestións tipo test. As cuestións tipo test teñen tres posibles respostas, das que soamente unha é correcta.
 Páxina 1 de 9 1. Formato da proba Formato proba constará de vinte cuestións tipo test. s cuestións tipo test teñen tres posibles respostas, das que soamente unha é correcta. Puntuación Puntuación: 0.5
Páxina 1 de 9 1. Formato da proba Formato proba constará de vinte cuestións tipo test. s cuestións tipo test teñen tres posibles respostas, das que soamente unha é correcta. Puntuación Puntuación: 0.5
Exercicios de Física 02a. Campo Eléctrico
 Exercicios de Física 02a. Campo Eléctrico Problemas 1. Dúas cargas eléctricas de 3 mc están situadas en A(4,0) e B( 4,0) (en metros). Caalcula: a) o campo eléctrico en C(0,5) e en D(0,0) b) o potencial
Exercicios de Física 02a. Campo Eléctrico Problemas 1. Dúas cargas eléctricas de 3 mc están situadas en A(4,0) e B( 4,0) (en metros). Caalcula: a) o campo eléctrico en C(0,5) e en D(0,0) b) o potencial
METABOLISMO. É a síntese de glicosa a partir de precursores non glicídicos (piruvato, lactato, aminoácidos, glicerol).
 1.- a) Que é a gliconeoxénese? É a síntese de glicosa a partir de precursores non glicídicos (piruvato, lactato, aminoácidos, glicerol). b) Indica brevemente en que consiste a glicólise, o lugar da célula
1.- a) Que é a gliconeoxénese? É a síntese de glicosa a partir de precursores non glicídicos (piruvato, lactato, aminoácidos, glicerol). b) Indica brevemente en que consiste a glicólise, o lugar da célula
S1301005 A REACCIÓN EN CADEA DA POLIMERASA (PCR) NA INDUSTRIA ALIMENTARIA EXTRACCIÓN DO ADN EXTRACCIÓN DO ADN CUANTIFICACIÓN. 260 280 260/280 ng/µl
 CUANTIFICACIÖN 26/VI/2013 S1301005 A REACCIÓN EN CADEA DA POLIMERASA (PCR) NA INDUSTRIA ALIMENTARIA - ESPECTROFOTÓMETRO: Cuantificación da concentración do ADN extraido. Medimos a absorbancia a dúas lonxitudes
CUANTIFICACIÖN 26/VI/2013 S1301005 A REACCIÓN EN CADEA DA POLIMERASA (PCR) NA INDUSTRIA ALIMENTARIA - ESPECTROFOTÓMETRO: Cuantificación da concentración do ADN extraido. Medimos a absorbancia a dúas lonxitudes
FISICA 2º BAC 27/01/2007
 POBLEMAS 1.- Un corpo de 10 g de masa desprázase cun movemento harmónico simple de 80 Hz de frecuencia e de 1 m de amplitude. Acha: a) A enerxía potencial cando a elongación é igual a 70 cm. b) O módulo
POBLEMAS 1.- Un corpo de 10 g de masa desprázase cun movemento harmónico simple de 80 Hz de frecuencia e de 1 m de amplitude. Acha: a) A enerxía potencial cando a elongación é igual a 70 cm. b) O módulo
Tema 1. Espazos topolóxicos. Topoloxía Xeral, 2016
 Tema 1. Espazos topolóxicos Topoloxía Xeral, 2016 Topoloxía e Espazo topolóxico Índice Topoloxía e Espazo topolóxico Exemplos de topoloxías Conxuntos pechados Topoloxías definidas por conxuntos pechados:
Tema 1. Espazos topolóxicos Topoloxía Xeral, 2016 Topoloxía e Espazo topolóxico Índice Topoloxía e Espazo topolóxico Exemplos de topoloxías Conxuntos pechados Topoloxías definidas por conxuntos pechados:
PAU XUÑO 2010 MATEMÁTICAS II
 PAU XUÑO 010 MATEMÁTICAS II Código: 6 (O alumno/a deber responder só aos eercicios dunha das opcións. Punuación máima dos eercicios de cada opción: eercicio 1= 3 punos, eercicio = 3 punos, eercicio 3 =
PAU XUÑO 010 MATEMÁTICAS II Código: 6 (O alumno/a deber responder só aos eercicios dunha das opcións. Punuación máima dos eercicios de cada opción: eercicio 1= 3 punos, eercicio = 3 punos, eercicio 3 =
Química 2º Bacharelato Equilibrio químico 11/02/08
 Química º Bacharelato Equilibrio químico 11/0/08 DEPARTAMENTO DE FÍSICA E QUÍMICA Nome: PROBLEMAS 1. Nun matraz de,00 litros introdúcense 0,0 10-3 mol de pentacloruro de fósforo sólido. Péchase, faise
Química º Bacharelato Equilibrio químico 11/0/08 DEPARTAMENTO DE FÍSICA E QUÍMICA Nome: PROBLEMAS 1. Nun matraz de,00 litros introdúcense 0,0 10-3 mol de pentacloruro de fósforo sólido. Péchase, faise
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES
 Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amonuíaco de concentración 0,01 mol/dm³ está ionizada nun 4,2 %. a) Escribe a reacción de disociación e calcula
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amonuíaco de concentración 0,01 mol/dm³ está ionizada nun 4,2 %. a) Escribe a reacción de disociación e calcula
Física P.A.U. GRAVITACIÓN 1 GRAVITACIÓN
 Física P.A.U. GRAVITACIÓN 1 GRAVITACIÓN PROBLEMAS SATÉLITES 1. O período de rotación da Terra arredor del Sol é un año e o radio da órbita é 1,5 10 11 m. Se Xúpiter ten un período de aproximadamente 12
Física P.A.U. GRAVITACIÓN 1 GRAVITACIÓN PROBLEMAS SATÉLITES 1. O período de rotación da Terra arredor del Sol é un año e o radio da órbita é 1,5 10 11 m. Se Xúpiter ten un período de aproximadamente 12
Resistencia de Materiais. Tema 5. Relacións entre tensións e deformacións
 Resistencia de Materiais. Tema 5. Relacións entre tensións e deformacións ARTURO NORBERTO FONTÁN PÉREZ Fotografía. Ponte Coalbrookdale (Gran Bretaña, 779). Van principal: 30.5 m. Contido. Tema 5. Relacións
Resistencia de Materiais. Tema 5. Relacións entre tensións e deformacións ARTURO NORBERTO FONTÁN PÉREZ Fotografía. Ponte Coalbrookdale (Gran Bretaña, 779). Van principal: 30.5 m. Contido. Tema 5. Relacións
TEMA 9. Como obteñen enerxía as células a partir do alimento
 TEMA 9. Como obteñen enerxía as células a partir do alimento As células requiren unha provisión constante de enerxía que provén da presente nas unións químicas das moléculas alimentarias. As máis importantes
TEMA 9. Como obteñen enerxía as células a partir do alimento As células requiren unha provisión constante de enerxía que provén da presente nas unións químicas das moléculas alimentarias. As máis importantes
Exame tipo. C. Problemas (Valoración: 5 puntos, 2,5 puntos cada problema)
 Exame tipo A. Proba obxectiva (Valoración: 3 puntos) 1. - Un disco de 10 cm de raio xira cunha velocidade angular de 45 revolucións por minuto. A velocidade lineal dos puntos da periferia do disco será:
Exame tipo A. Proba obxectiva (Valoración: 3 puntos) 1. - Un disco de 10 cm de raio xira cunha velocidade angular de 45 revolucións por minuto. A velocidade lineal dos puntos da periferia do disco será:
INTERACCIÓNS GRAVITATORIA E ELECTROSTÁTICA
 INTEACCIÓNS GAVITATOIA E ELECTOSTÁTICA AS LEIS DE KEPLE O astrónomo e matemático Johannes Kepler (1571 1630) enunciou tres leis que describen o movemento planetario a partir do estudo dunha gran cantidade
INTEACCIÓNS GAVITATOIA E ELECTOSTÁTICA AS LEIS DE KEPLE O astrónomo e matemático Johannes Kepler (1571 1630) enunciou tres leis que describen o movemento planetario a partir do estudo dunha gran cantidade
As Mareas INDICE. 1. Introducción 2. Forza das mareas 3. Por que temos dúas mareas ó día? 4. Predición de marea 5. Aviso para a navegación
 As Mareas INDICE 1. Introducción 2. Forza das mareas 3. Por que temos dúas mareas ó día? 4. Predición de marea 5. Aviso para a navegación Introducción A marea é a variación do nivel da superficie libre
As Mareas INDICE 1. Introducción 2. Forza das mareas 3. Por que temos dúas mareas ó día? 4. Predición de marea 5. Aviso para a navegación Introducción A marea é a variación do nivel da superficie libre
Teoría cinética e atómica da materia
 Educación secundaria para persoas adultas Ámbito científico tecnolóxico Módulo 3 Unidade didáctica 3 Teoría cinética e atómica da materia Páxina 1 de 65 Índice 1. Programación da unidade...4 1.1 Encadramento
Educación secundaria para persoas adultas Ámbito científico tecnolóxico Módulo 3 Unidade didáctica 3 Teoría cinética e atómica da materia Páxina 1 de 65 Índice 1. Programación da unidade...4 1.1 Encadramento
Profesor: Guillermo F. Cloos Física e química 1º Bacharelato Estrutura atómica 2 1
 As leis ponderais e volumétricas, estudadas no anterior tema, analizadas á luz da teoría atómica que hoxe manexamos resultan ser unha consecuencia lóxica da mesma, pero non debemos esquecer que historicamente
As leis ponderais e volumétricas, estudadas no anterior tema, analizadas á luz da teoría atómica que hoxe manexamos resultan ser unha consecuencia lóxica da mesma, pero non debemos esquecer que historicamente
TEMA 10: METABOLISMO
 TEMA 10: METABOLISMO - Concepto de catabolismo e mecanismo xeral de obtención de enerxía (ATP, respiración, fermentación). Panorama xeral do catabolismo (glícidos, lípidos e aminoácidos). - Glicólise,
TEMA 10: METABOLISMO - Concepto de catabolismo e mecanismo xeral de obtención de enerxía (ATP, respiración, fermentación). Panorama xeral do catabolismo (glícidos, lípidos e aminoácidos). - Glicólise,
REACCIÓNS DE TRANSFERENCIA DE PROTÓNS
 REACCIÓNS DE TRANSFERENCIA DE PROTÓNS 1. Concepto de ácido e base segundo as teorías de Arrhenius e Brönsted-Lowry. 2. Concepto de par ácido-base conxugado. 3. Forza relativa dos ácidos e bases. Grao de
REACCIÓNS DE TRANSFERENCIA DE PROTÓNS 1. Concepto de ácido e base segundo as teorías de Arrhenius e Brönsted-Lowry. 2. Concepto de par ácido-base conxugado. 3. Forza relativa dos ácidos e bases. Grao de
Tema 3. Propiedades eléctricas
 Tema 3. Propiedades eléctricas 1.Condución eléctrica 1.1 Lei de Ohm Unha das máis importantes características eléctricas dun material sólido é a facilidade coa que transmite unha corrente eléctrica. A
Tema 3. Propiedades eléctricas 1.Condución eléctrica 1.1 Lei de Ohm Unha das máis importantes características eléctricas dun material sólido é a facilidade coa que transmite unha corrente eléctrica. A
PAU XUÑO 2011 MATEMÁTICAS II
 PAU XUÑO 2011 MATEMÁTICAS II Código: 26 (O alumno/a debe responder só os exercicios dunha das opcións. Puntuación máxima dos exercicios de cada opción: exercicio 1= 3 puntos, exercicio 2= 3 puntos, exercicio
PAU XUÑO 2011 MATEMÁTICAS II Código: 26 (O alumno/a debe responder só os exercicios dunha das opcións. Puntuación máxima dos exercicios de cada opción: exercicio 1= 3 puntos, exercicio 2= 3 puntos, exercicio
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA
 Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. Para o proceso Fe 2O 3 (s) + 2 Al (s) Al 2O 3 (s) + 2 Fe (s), calcule: a) A entalpía da reacción en condicións estándar e a calor desprendida
Química P.A.U. TERMOQUÍMICA 1 TERMOQUÍMICA PROBLEMAS TERMOQUÍMICA 1. Para o proceso Fe 2O 3 (s) + 2 Al (s) Al 2O 3 (s) + 2 Fe (s), calcule: a) A entalpía da reacción en condicións estándar e a calor desprendida
Física A.B.A.U. GRAVITACIÓN 1 GRAVITACIÓN
 Física A.B.A.U. GRAVITACIÓN 1 GRAVITACIÓN PROBLEMAS 1. A luz do Sol tarda 5 10² s en chegar á Terra e 2,6 10³ s en chegar a Xúpiter. a) O período de Xúpiter orbitando arredor do Sol. b) A velocidade orbital
Física A.B.A.U. GRAVITACIÓN 1 GRAVITACIÓN PROBLEMAS 1. A luz do Sol tarda 5 10² s en chegar á Terra e 2,6 10³ s en chegar a Xúpiter. a) O período de Xúpiter orbitando arredor do Sol. b) A velocidade orbital
CARACTERÍSTICAS DOS SERES VIVOS
 CARACTERÍSTICAS DOS SERES VIVOS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía. A BIOLOXÍA (do grego «βιος» bios, vida, e «λóγος» logos, razoamento, estudo, ciencia) ten como obxecto de estudo aos
CARACTERÍSTICAS DOS SERES VIVOS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía. A BIOLOXÍA (do grego «βιος» bios, vida, e «λóγος» logos, razoamento, estudo, ciencia) ten como obxecto de estudo aos
Curso LÍPIDOS. Tema 3. Bioloxía 2º Bacharelato
 Curso 2014-2015 LÍPIDOS Tema 3 Bioloxía 2º Bacharelato Temario CIUGA Tema 3 Lípidos. Concepto, clasificación e funcións biolóxicas dos lípidos. Estrutura, propiedades e funcións dos ácidos graxos. Lípidos
Curso 2014-2015 LÍPIDOS Tema 3 Bioloxía 2º Bacharelato Temario CIUGA Tema 3 Lípidos. Concepto, clasificación e funcións biolóxicas dos lípidos. Estrutura, propiedades e funcións dos ácidos graxos. Lípidos
Física P.A.U. ÓPTICA 1 ÓPTICA
 Física P.A.U. ÓPTICA 1 ÓPTICA PROBLEMAS DIOPTRIO PLANO 1. Un raio de luz de frecuencia 5 10¹⁴ Hz incide cun ángulo de incidencia de 30 sobre unha lámina de vidro de caras plano-paralelas de espesor 10
Física P.A.U. ÓPTICA 1 ÓPTICA PROBLEMAS DIOPTRIO PLANO 1. Un raio de luz de frecuencia 5 10¹⁴ Hz incide cun ángulo de incidencia de 30 sobre unha lámina de vidro de caras plano-paralelas de espesor 10
EXERCICIOS DE ÁLXEBRA. PAU GALICIA
 Maemáicas II EXERCICIOS DE ÁLXEBRA PAU GALICIA a) (Xuño ) Propiedades do produo de marices (só enuncialas) b) (Xuño ) Sexan M e N M + I, onde I denoa a mariz idenidade de orde n, calcule N e M 3 Son M
Maemáicas II EXERCICIOS DE ÁLXEBRA PAU GALICIA a) (Xuño ) Propiedades do produo de marices (só enuncialas) b) (Xuño ) Sexan M e N M + I, onde I denoa a mariz idenidade de orde n, calcule N e M 3 Son M
Código: 25 PAU XUÑO 2014 FÍSICA OPCIÓN A OPCIÓN B
 PAU XUÑO 2014 Código: 25 FÍSICA Puntuación máxima: Cuestións 4 puntos (1 cada cuestión, teórica ou práctica). Problemas 6 puntos (1 cada apartado). Non se valorará a simple anotación dun ítem como solución
PAU XUÑO 2014 Código: 25 FÍSICA Puntuación máxima: Cuestións 4 puntos (1 cada cuestión, teórica ou práctica). Problemas 6 puntos (1 cada apartado). Non se valorará a simple anotación dun ítem como solución
Física P.A.U. ÓPTICA 1 ÓPTICA
 Física P.A.U. ÓPTICA 1 ÓPTICA PROBLEMAS DIOPTRIO PLANO 1. Un raio de luz de frecuencia 5 10 14 Hz incide, cun ángulo de incidencia de 30, sobre unha lámina de vidro de caras plano-paralelas de espesor
Física P.A.U. ÓPTICA 1 ÓPTICA PROBLEMAS DIOPTRIO PLANO 1. Un raio de luz de frecuencia 5 10 14 Hz incide, cun ángulo de incidencia de 30, sobre unha lámina de vidro de caras plano-paralelas de espesor
ÁCIDOS NUCLEICOS. Carmen Cid Manzano. I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 ÁCIDOS NUCLEICOS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. Os ácidos nucleicos foron descubertos por Freidrich Miescher en 1869. Este científico traballando con
ÁCIDOS NUCLEICOS Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía. Os ácidos nucleicos foron descubertos por Freidrich Miescher en 1869. Este científico traballando con
Lípidos. Clasificación
 Lípidos Son compuestos encontrados en organismos vivos, generalmente solubles en solventes orgánicos e insolubles en agua. Clasificación Propiedades físicas aceites grasas Estructura simples complejos
Lípidos Son compuestos encontrados en organismos vivos, generalmente solubles en solventes orgánicos e insolubles en agua. Clasificación Propiedades físicas aceites grasas Estructura simples complejos
Física P.A.U. VIBRACIÓNS E ONDAS 1 VIBRACIÓNS E ONDAS
 Física P.A.U. VIBRACIÓNS E ONDAS 1 VIBRACIÓNS E ONDAS PROBLEMAS M.H.S.. 1. Dun resorte elástico de constante k = 500 N m -1 colga unha masa puntual de 5 kg. Estando o conxunto en equilibrio, desprázase
Física P.A.U. VIBRACIÓNS E ONDAS 1 VIBRACIÓNS E ONDAS PROBLEMAS M.H.S.. 1. Dun resorte elástico de constante k = 500 N m -1 colga unha masa puntual de 5 kg. Estando o conxunto en equilibrio, desprázase
TEMA. Clasificación de proteínas Criterios de clasificación Unión de ligandos en proteínas funcionalmente activas
 TEMA Clasificación de proteínas Criterios de clasificación Unión de ligandos en proteínas funcionalmente activas Criterios de clasificación: COMPOSICIÓN HOMOPROTEÍNAS O PROTEÍNAS SIMPLES HETEROPROTEÍNAS
TEMA Clasificación de proteínas Criterios de clasificación Unión de ligandos en proteínas funcionalmente activas Criterios de clasificación: COMPOSICIÓN HOMOPROTEÍNAS O PROTEÍNAS SIMPLES HETEROPROTEÍNAS
ln x, d) y = (3x 5 5x 2 + 7) 8 x
 EXERCICIOS AUTOAVALIABLES: CÁLCULO DIFERENCIAL. Deriva: a) y 7 6 + 5, b) y e, c) y e) y 7 ( 5 ), f) y ln, d) y ( 5 5 + 7) 8 n e ln, g) y, h) y n. Usando a derivada da función inversa, demostra que: a)
EXERCICIOS AUTOAVALIABLES: CÁLCULO DIFERENCIAL. Deriva: a) y 7 6 + 5, b) y e, c) y e) y 7 ( 5 ), f) y ln, d) y ( 5 5 + 7) 8 n e ln, g) y, h) y n. Usando a derivada da función inversa, demostra que: a)
TRIGONOMETRIA. hipotenusa L 2. hipotenusa
 TRIGONOMETRIA. Calcular las razones trigonométricas de 0º, º y 60º. Para calcular las razones trigonométricas de º, nos ayudamos de un triángulo rectángulo isósceles como el de la figura. cateto opuesto
TRIGONOMETRIA. Calcular las razones trigonométricas de 0º, º y 60º. Para calcular las razones trigonométricas de º, nos ayudamos de un triángulo rectángulo isósceles como el de la figura. cateto opuesto
8. Tampón fosfato, tampón bicarbonato. Substancias ANFÓTERAS 9. De que moléculas se trata? Como se chama o carbono nº 1?. Como se chama o enlace?
 Repaso 1. Cales son os bioelementos primarios? Cales son os secundarios? Definición de oligoelementos. 2. Enlaces fortes? Enlaces débiles? 3. Estrutura da auga. Enlaces que se establecen entre as distintas
Repaso 1. Cales son os bioelementos primarios? Cales son os secundarios? Definición de oligoelementos. 2. Enlaces fortes? Enlaces débiles? 3. Estrutura da auga. Enlaces que se establecen entre as distintas
EQUILIBRIOS ÁCIDO-BASE
 EQUILIBRIOS ÁCIDO-BASE 1- ÁCIDOS E BASES. DEFINICIÓN SEGUNDO AS TEORÍAS DE ARRHENIUS E BRÖNSTED-LOWRY. Arrhenius.- Ácido. substancia que en disolución acuosa disóciase producindo ións H. ( auga) AH H (aq.)
EQUILIBRIOS ÁCIDO-BASE 1- ÁCIDOS E BASES. DEFINICIÓN SEGUNDO AS TEORÍAS DE ARRHENIUS E BRÖNSTED-LOWRY. Arrhenius.- Ácido. substancia que en disolución acuosa disóciase producindo ións H. ( auga) AH H (aq.)
PAAU (LOXSE) Xuño 2002
 PAAU (LOXSE) Xuño 00 Código: FÍSICA Elixir e desenvolver unha das dúas opcións propostas. Puntuación máxima: Problemas 6 puntos (1,5 cada apartado). Cuestións 4 puntos (1 cada cuestión, teórica ou práctica).
PAAU (LOXSE) Xuño 00 Código: FÍSICA Elixir e desenvolver unha das dúas opcións propostas. Puntuación máxima: Problemas 6 puntos (1,5 cada apartado). Cuestións 4 puntos (1 cada cuestión, teórica ou práctica).
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO
 Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm 3 contén unha mestura gasosa en equilibrio de 0,003 moles de hidróxeno, 0,003 moles de iodo e
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm 3 contén unha mestura gasosa en equilibrio de 0,003 moles de hidróxeno, 0,003 moles de iodo e
Química A Extensivo V. 5
 Extensivo V. 5 Resolva Aula 17 17.01) 7 0. Correta. vetor eletronegatividade C linear apolar C μ R = 0 angular polar μ 0 R 08. Incorreta. N 3 piramidal polar N μ 0 R C tetraédrica apolar μ = 0 R 16. Incorreta.
Extensivo V. 5 Resolva Aula 17 17.01) 7 0. Correta. vetor eletronegatividade C linear apolar C μ R = 0 angular polar μ 0 R 08. Incorreta. N 3 piramidal polar N μ 0 R C tetraédrica apolar μ = 0 R 16. Incorreta.
Manual de técnicas experimentais en bioloxía molecular e celular
 Manual de técnicas experimentais en bioloxía molecular e celular Alejandro de Carlos Villamarín Jose Manuel Faro Rivas África González Fernández Vicenta Soledad Martínez Zorzano Manuel Megías Pacheco Pilar
Manual de técnicas experimentais en bioloxía molecular e celular Alejandro de Carlos Villamarín Jose Manuel Faro Rivas África González Fernández Vicenta Soledad Martínez Zorzano Manuel Megías Pacheco Pilar
PAU XUÑO 2016 BIOLOXÍA
 PAU XUÑO 2016 Código: 21 BIOLOXÍA Estrutura da proba: a proba componse de dúas opcións: A e B. Só se poderá contestar unha das dúas opcións, desenvolvendo integramente o seu contido. Puntuación: a cualificación
PAU XUÑO 2016 Código: 21 BIOLOXÍA Estrutura da proba: a proba componse de dúas opcións: A e B. Só se poderá contestar unha das dúas opcións, desenvolvendo integramente o seu contido. Puntuación: a cualificación
EXERCICIOS DE REFORZO: SISTEMAS DE ECUACIÓNS LINEAIS
 EXERCICIOS DE REFORZO: SISTEMAS DE ECUACIÓNS LINEAIS. ) Clul os posiles vlores de,, pr que triz A verifique relión (A I), sendo I triz identidde de orde e triz nul de orde. ) Cl é soluión dun siste hooéneo
EXERCICIOS DE REFORZO: SISTEMAS DE ECUACIÓNS LINEAIS. ) Clul os posiles vlores de,, pr que triz A verifique relión (A I), sendo I triz identidde de orde e triz nul de orde. ) Cl é soluión dun siste hooéneo
MÓDULO 3 SEMIPRESENCIAL NATUREZA UNIDADE 2: MESTURAS E DISOLUCIÓNS 1. UNIDADE 2 Mesturas e disolucións
 MÓDULO 3 SEMIPRESENCIAL NATUREZA UNIDADE 2: MESTURAS E DISOLUCIÓNS 1 UNIDADE 2 Mesturas e disolucións 2.1. Coñecer as características dos tres estados da materia. 2.2. Diferenciar substancias puras e mesturas.
MÓDULO 3 SEMIPRESENCIAL NATUREZA UNIDADE 2: MESTURAS E DISOLUCIÓNS 1 UNIDADE 2 Mesturas e disolucións 2.1. Coñecer as características dos tres estados da materia. 2.2. Diferenciar substancias puras e mesturas.
ÁCIDOS NUCLEICOS. Carmen Cid Manzano I.E.S. Otero Pedrayo. Ourense. Departamento Bioloxía e Xeoloxía.
 ÁCIDOS NUCLEICOS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía. Os ácidos nucleicos foron descubertos por Freidrich Miescher en 1869. Este científico traballando con leucocitos e espermatozoides
ÁCIDOS NUCLEICOS Carmen Cid Manzano. Departamento Bioloxía e Xeoloxía. Os ácidos nucleicos foron descubertos por Freidrich Miescher en 1869. Este científico traballando con leucocitos e espermatozoides
Problemas y cuestiones de electromagnetismo
 Problemas y cuestiones de electromagnetismo 1.- Dúas cargas eléctricas puntuais de 2 e -2 µc cada unha están situadas respectivamente en (2,0) e en (-2,0) (en metros). Calcule: a) campo eléctrico en (0,0)
Problemas y cuestiones de electromagnetismo 1.- Dúas cargas eléctricas puntuais de 2 e -2 µc cada unha están situadas respectivamente en (2,0) e en (-2,0) (en metros). Calcule: a) campo eléctrico en (0,0)
Eletromagnetismo. Johny Carvalho Silva Universidade Federal do Rio Grande Instituto de Matemática, Física e Estatística. ...:: Solução ::...
 Eletromagnetismo Johny Carvalho Silva Universidade Federal do Rio Grande Instituto de Matemática, Física e Estatística Lista -.1 - Mostrar que a seguinte medida é invariante d 3 p p 0 onde: p 0 p + m (1)
Eletromagnetismo Johny Carvalho Silva Universidade Federal do Rio Grande Instituto de Matemática, Física e Estatística Lista -.1 - Mostrar que a seguinte medida é invariante d 3 p p 0 onde: p 0 p + m (1)
ÁCIDOS ORGÁNICOS MAS COMUNES
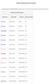 ÁCIDOS ORGÁNICOS MAS COMUNES Los nombres triviales de los ácidos carboxílicos se designan según la fuente natural de la que inicialmente se aislaron. Se clasificaron así: Nombres de los ácidos carboxílicos
ÁCIDOS ORGÁNICOS MAS COMUNES Los nombres triviales de los ácidos carboxílicos se designan según la fuente natural de la que inicialmente se aislaron. Se clasificaron así: Nombres de los ácidos carboxílicos
Física P.A.U. ELECTROMAGNETISMO 1 ELECTROMAGNETISMO
 Física P.A.U. ELECTROMAGNETISMO 1 ELECTROMAGNETISMO PROBLEMAS CAMPO ELECTROSTÁTICO 1. Dúas cargas eléctricas de 3 mc están situadas en A(4, 0) e B(-4, 0) (en metros). Calcula: a) O campo eléctrico en C(0,
Física P.A.U. ELECTROMAGNETISMO 1 ELECTROMAGNETISMO PROBLEMAS CAMPO ELECTROSTÁTICO 1. Dúas cargas eléctricas de 3 mc están situadas en A(4, 0) e B(-4, 0) (en metros). Calcula: a) O campo eléctrico en C(0,
PAU Setembro 2010 FÍSICA
 PAU Setembro 010 Código: 5 FÍSICA Puntuación máxima: Cuestións 4 puntos (1 cada cuestión, teórica ou práctica). Problemas 6 puntos (1 cada apartado). Non se valorará a simple anotación dun ítem como solución
PAU Setembro 010 Código: 5 FÍSICA Puntuación máxima: Cuestións 4 puntos (1 cada cuestión, teórica ou práctica). Problemas 6 puntos (1 cada apartado). Non se valorará a simple anotación dun ítem como solución
Métodos Matemáticos en Física L4F. CONDICIONES de CONTORNO+Fuerzas Externas (Cap. 3, libro APL)
 L4F. CONDICIONES de CONTORNO+Fuerzas Externas (Cap. 3, libro Condiciones de contorno. Fuerzas externas aplicadas sobre una cuerda. condición que nos describe un extremo libre en una cuerda tensa. Ecuación
L4F. CONDICIONES de CONTORNO+Fuerzas Externas (Cap. 3, libro Condiciones de contorno. Fuerzas externas aplicadas sobre una cuerda. condición que nos describe un extremo libre en una cuerda tensa. Ecuación
PAU XUÑO 2014 QUÍMICA. Cualificación: O alumno elixirá UNHA das dúas opcións. Cada pregunta cualificarase con 2 puntos. OPCIÓN A
 PAU Código: 27 XUÑO 2014 QUÍMICA Cualificación: O alumno elixirá UNHA das dúas opcións. Cada pregunta cualificarase con 2 puntos. OPCIÓN A 1. 1.1. Dados os seguintes elementos: B, O, C e F, ordéneos en
PAU Código: 27 XUÑO 2014 QUÍMICA Cualificación: O alumno elixirá UNHA das dúas opcións. Cada pregunta cualificarase con 2 puntos. OPCIÓN A 1. 1.1. Dados os seguintes elementos: B, O, C e F, ordéneos en
Exercicios de Física 04. Óptica
 Exercicios de Física 04. Óptica Problemas 1. Unha lente converxente ten unha distancia focal de 50 cm. Calcula a posición do obxecto para que a imaxe sexa: a) real e tres veces maior que o obxecto, b)
Exercicios de Física 04. Óptica Problemas 1. Unha lente converxente ten unha distancia focal de 50 cm. Calcula a posición do obxecto para que a imaxe sexa: a) real e tres veces maior que o obxecto, b)
As nanopartículas metálicas
 As nanopartículas metálicas Manolo R. Bermejo Ana M. González Noya Marcelino Maneiro Rosa Pedrido Departamento de Química Inorgánica Contido Introdución Qué son os NANOMATERIAIS INORGÁNICOS Qué son as
As nanopartículas metálicas Manolo R. Bermejo Ana M. González Noya Marcelino Maneiro Rosa Pedrido Departamento de Química Inorgánica Contido Introdución Qué son os NANOMATERIAIS INORGÁNICOS Qué son as
PAU XUÑO QUÍMICA Cualificación: O alumno elixirá UNHA das dúas opcións. Cada pregunta cualificarase con 2 puntos. OPCIÓN A
 PAU XUÑO 2014 Código: 27 QUÍMICA Cualificación: O alumno elixirá UNHA das dúas opcións. Cada pregunta cualificarase con 2 puntos. OPCIÓN A 1. 1.1. Dados os seguintes elementos: B, O, C e F, ordéneos en
PAU XUÑO 2014 Código: 27 QUÍMICA Cualificación: O alumno elixirá UNHA das dúas opcións. Cada pregunta cualificarase con 2 puntos. OPCIÓN A 1. 1.1. Dados os seguintes elementos: B, O, C e F, ordéneos en
Código: 25 XUÑO 2014 PAU FÍSICA OPCIÓN A OPCIÓN B
 PAU Código: 25 XUÑO 204 FÍSICA Puntuación máxima: Cuestións 4 puntos ( cada cuestión, teórica ou práctica). Problemas 6 puntos ( cada apartado). Non se valorará a simple anotación dun ítem como solución
PAU Código: 25 XUÑO 204 FÍSICA Puntuación máxima: Cuestións 4 puntos ( cada cuestión, teórica ou práctica). Problemas 6 puntos ( cada apartado). Non se valorará a simple anotación dun ítem como solución
ÓPTICA- A LUZ Problemas PAAU
 ÓPTICA- A LUZ Problemas PAAU XUÑO-96 CUESTION 2. opa Disponse de luz monocromática capaz de extraer electróns dun metal. A medida que medra a lonxitude de onda da luz incidente, a) os electróns emitidos
ÓPTICA- A LUZ Problemas PAAU XUÑO-96 CUESTION 2. opa Disponse de luz monocromática capaz de extraer electróns dun metal. A medida que medra a lonxitude de onda da luz incidente, a) os electróns emitidos
1 La teoría de Jeans. t + (n v) = 0 (1) b) Navier-Stokes (conservación del impulso) c) Poisson
 1 La teoría de Jeans El caso ás siple de evolución de fluctuaciones es el de un fluído no relativista. las ecuaciones básicas son: a conservación del núero de partículas n t + (n v = 0 (1 b Navier-Stokes
1 La teoría de Jeans El caso ás siple de evolución de fluctuaciones es el de un fluído no relativista. las ecuaciones básicas son: a conservación del núero de partículas n t + (n v = 0 (1 b Navier-Stokes
Ventiladores helicoidales murales o tubulares, versión PL equipados con hélice de plástico y versión AL equipados con hélice de aluminio.
 HCH HCT HCH HCT Ventiladores helicoidales murales o tubulares, de gran robustez Ventiladores helicoidales murales o tubulares, versión PL equipados con hélice de plástico y versión AL equipados con hélice
HCH HCT HCH HCT Ventiladores helicoidales murales o tubulares, de gran robustez Ventiladores helicoidales murales o tubulares, versión PL equipados con hélice de plástico y versión AL equipados con hélice
Lógica Proposicional. Justificación de la validez del razonamiento?
 Proposicional educción Natural Proposicional - 1 Justificación de la validez del razonamiento? os maneras diferentes de justificar Justificar que la veracidad de las hipótesis implica la veracidad de la
Proposicional educción Natural Proposicional - 1 Justificación de la validez del razonamiento? os maneras diferentes de justificar Justificar que la veracidad de las hipótesis implica la veracidad de la
PAU XUÑO 2011 FÍSICA
 PAU XUÑO 2011 Código: 25 FÍSICA Puntuación máxima: Cuestións 4 puntos (1 cada cuestión, teórica ou práctica). Problemas 6 puntos (1 cada apartado). Non se valorará a simple anotación dun ítem como solución
PAU XUÑO 2011 Código: 25 FÍSICA Puntuación máxima: Cuestións 4 puntos (1 cada cuestión, teórica ou práctica). Problemas 6 puntos (1 cada apartado). Non se valorará a simple anotación dun ítem como solución
1.- Enerxía interna! Temperatura! Calor! Dilatación! Cambios de estado! Transmisión do calor! 8
 1.- Enerxía interna! 2 2.- Temperatura! 2 2.1.- Termómetros! 2 3.- Calor! 4 3.1.- Calor específico! 4 3.2.- Equilibrio térmico! 4 4.- Dilatación! 5 4.1.- Dilatación de sólidos! 5 4.2.- Dilatación de líquidos!
1.- Enerxía interna! 2 2.- Temperatura! 2 2.1.- Termómetros! 2 3.- Calor! 4 3.1.- Calor específico! 4 3.2.- Equilibrio térmico! 4 4.- Dilatación! 5 4.1.- Dilatación de sólidos! 5 4.2.- Dilatación de líquidos!
CUESTIÓNS DE SELECTIVIDADE RELACIONADOS CO TEMA 4
 CUESTIÓNS DE SELECTIVIDADE RELACIONADOS CO TEMA 4 2013 C.2. Se se desexa obter unha imaxe virtual, dereita e menor que o obxecto, úsase: a) un espello convexo; b)unha lente converxente; c) un espello cóncavo.
CUESTIÓNS DE SELECTIVIDADE RELACIONADOS CO TEMA 4 2013 C.2. Se se desexa obter unha imaxe virtual, dereita e menor que o obxecto, úsase: a) un espello convexo; b)unha lente converxente; c) un espello cóncavo.
Palabra derivada de glicosa pois se pensaba que tódolos glícidos procedian desta. As biomoléculas máis abundantes da natureza
 Palabra derivada de glicosa pois se pensaba que tódolos glícidos procedian desta. As biomoléculas máis abundantes da natureza GLÍCIDOS : características xerais Biomoléculas formadas por C, H y O, en una
Palabra derivada de glicosa pois se pensaba que tódolos glícidos procedian desta. As biomoléculas máis abundantes da natureza GLÍCIDOS : características xerais Biomoléculas formadas por C, H y O, en una
Química 2º Bacharelato Cálculos elementais e Termoquímica 14/01/08
 Química 2º Bacharelato álculos elementais e Termoquímica 14/1/8 DEPARTAMENTO DE FÍSIA E QUÍMIA Nome: UALIFIAIÓN: UESTIÓNS =2 PUNTOS ADA UNHA; PROBLEMAS: 2 PUNTOS ADA UN; PRÁTIA: 2 PUNTOS PROBLEMAS (Responda
Química 2º Bacharelato álculos elementais e Termoquímica 14/1/8 DEPARTAMENTO DE FÍSIA E QUÍMIA Nome: UALIFIAIÓN: UESTIÓNS =2 PUNTOS ADA UNHA; PROBLEMAS: 2 PUNTOS ADA UN; PRÁTIA: 2 PUNTOS PROBLEMAS (Responda
Preguntas V e F (selectividade):
 Preguntas V e F (selectividade): 2002 F- As vacinas proporcionan inmunidade artificial pasiva. F- Algúns xenes teñen intróns, exóns e axóns. F- A difusión pasiva non require transportadores. V- Os polisomas
Preguntas V e F (selectividade): 2002 F- As vacinas proporcionan inmunidade artificial pasiva. F- Algúns xenes teñen intróns, exóns e axóns. F- A difusión pasiva non require transportadores. V- Os polisomas
PROBA DE AVALIACIÓN DO BACHARELATO PARA O ACCESO Á UNIVERSIDADE (ABAU) CONVOCATORIA DE XUÑO Curso
 PROBA DE AVALIACIÓN DO BACHARELATO PARA O ACCESO Á UNIVERSIDADE (ABAU) CONVOCATORIA DE XUÑO Curso 2017-2018 Elixir e desenvolver unha das dúas opcións. As solución numéricas non acompañadas de unidades
PROBA DE AVALIACIÓN DO BACHARELATO PARA O ACCESO Á UNIVERSIDADE (ABAU) CONVOCATORIA DE XUÑO Curso 2017-2018 Elixir e desenvolver unha das dúas opcións. As solución numéricas non acompañadas de unidades
IX. ESPAZO EUCLÍDEO TRIDIMENSIONAL: Aplicacións ao cálculo de distancias, áreas e volumes
 IX. ESPAZO EUCLÍDEO TRIDIMENSIONAL: Aplicacións ao cálculo de distancias, áreas e volumes 1.- Distancia entre dous puntos Se A e B son dous puntos do espazo, defínese a distancia entre A e B como o módulo
IX. ESPAZO EUCLÍDEO TRIDIMENSIONAL: Aplicacións ao cálculo de distancias, áreas e volumes 1.- Distancia entre dous puntos Se A e B son dous puntos do espazo, defínese a distancia entre A e B como o módulo
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES
 Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amoníaco de concentración 0,01 mol/dm 3 está ionizada nun 4,2 %. a) Escriba a reacción de disociación e calcule
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amoníaco de concentración 0,01 mol/dm 3 está ionizada nun 4,2 %. a) Escriba a reacción de disociación e calcule
EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS
 Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm³ contén unha mestura gasosa en equilibrio de 0,003 moles de hidróxeno, 0,003 moles de iodo e
Química P.A.U. EQUILIBRIO QUÍMICO 1 EQUILIBRIO QUÍMICO PROBLEMAS FASE GAS 1. A 670 K, un recipiente de 2 dm³ contén unha mestura gasosa en equilibrio de 0,003 moles de hidróxeno, 0,003 moles de iodo e
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES
 Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amoníaco de concentración 0,01 mol/dm 3 está ionizada nun 4,2%. a) Escriba a reacción de disociación e calcule
Química P.A.U. ÁCIDOS E BASES 1 ÁCIDOS E BASES PROBLEMAS ÁCIDO/BASE DÉBIL 1. Unha disolución de amoníaco de concentración 0,01 mol/dm 3 está ionizada nun 4,2%. a) Escriba a reacción de disociación e calcule
